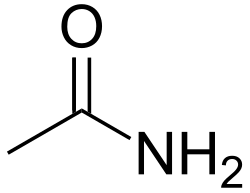
Ацетамид
| Ацетамид | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Acetamide Ethanamide |
||
| Хим. формула | CH3CONH2 | ||
| Физические свойства | |||
| Молярная масса | 59,07 г/моль | ||
| Плотность | 1,16 г/см³ | ||
| Энергия ионизации | 9,65 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 79-81 °C | ||
| • кипения | 221,2 °C | ||
| • вспышки | 154,4 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 15,1[2] и 0,63[3] | ||
| Оптические свойства | |||
| Показатель преломления | 1,4278[4] | ||
| Структура | |||
| Дипольный момент | 3,68 ± 0,03 Д[5] и 1,3E−29 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 60-35-5 | ||
| PubChem | 178 | ||
| Рег. номер EINECS | 200-473-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | AB4025000 | ||
| ChEBI | 27856 | ||
| ChemSpider | 173 | ||
| Безопасность | |||
| ЛД50 | ок. 10000 мг/кг | ||
| Фразы риска (R) | R40 | ||
| Фразы безопасности (S) | (S2) S36/37 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ацетамид CH3CONH2 — амид уксусной кислоты.
Физические и химические свойства
Ацетамид представляет собой игольчатые кристаллы с мышиным запахом, расплывающиеся на влажном воздухе. Хорошо растворим в воде, горячем спирте и ряде органических растворителей, практически нерастворим в бензоле и эфире.
Ацетамид является довольно устойчивым соединением: практически не разлагается при температуре своего кипения при нормальном давлении (221,5 °C), очень медленно разлагается холодными кислотами и щелочами. С горячей щёлочью даёт соответствующий ацетат и аммиак, при кипячении с водным раствором кислоты даёт уксусную кислоту и соответствующую соль аммония. Перегретым водным паром ацетамид разлагается на уксусную кислоту и аммиак.
Ацетамид амфотерен: при взаимодействии с сильными неорганическими кислотами образует нестойкие соли:
способен давать соли с щелочами:
Нагревание ацетамида в токе сухого HCl даёт хлорид аммония и диацетамид (CH3CO)2NH.
При дегидратации ацетамид образует ацетонитрил, в реакции с гипохлоритами щелочных металлов образует метиламин.
Получение и применение
Ацетамид можно получить:
- Реакцией этилацетата с водным раствором аммиака на холоде.
- Разложением сухого ацетата аммония. Реакцию лучше вести в присутствии 100%-й уксусной кислоты в качестве катализатора. Можно также сплавлять сухой ацетат аммония с сухой мочевиной в качестве водоотнимающего средства (при этом выделяется аммиак и углекислый газ).
- Пропусканием аммиака в горячий уксусный ангидрид.
- Нагреванием смеси безводного ацетата натрия с хлоридом аммония (реакция даёт малый выход ацетамида).
Ацетамид используется в качестве пластификатора в процессах получения кожи, бумаги, плёнок и лакокрасочных материалов. Он используется как исходное вещество для получения N-хлор- и N-бромацетамидов, тиоацетамида, метиламина, ряда лекарственных средств.
Известен природный амид уксусной кислоты, являющийся минералом.
Токсичность
Ацетамид может являться потенциально канцерогенным веществом[6].
Примечания
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 5—88. — ISBN 978-1-4987-5428-6
- ↑ Acetamide (англ.)
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 3—4. — ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 9—60. — ISBN 978-1-4987-5428-6
- ↑ Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с.
Ссылки
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Ацетамид // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Категория:Ацетамиды