Пентаналь
| Пентаналь | |
|---|---|
 | |
| Общие | |
| Хим. формула | C5H10O |
| Физические свойства | |
| Молярная масса | 86,13 г/моль |
| Плотность | 0,81 ± 0,01 г/см³[1] |
| Энергия ионизации | 9,82 ± 0,01 эВ[1] и 9,74 эВ[2] |
| Термические свойства | |
| Температура | |
| • плавления | −133 ± 1 ℉[1], −92 °C[3] и −91,5 °C[2] |
| • кипения | 217 ± 1 ℉[1] и 103 °C[2] |
| • вспышки | 54 ± 1 ℉[1] |
| Давление пара | 26 ± 1 мм рт.ст.[1] |
| Классификация | |
| Рег. номер CAS | 110-62-3 |
| PubChem | 8063 |
| Рег. номер EINECS | 203-784-4 |
| SMILES | |
| InChI | |
| RTECS | YV3600000 |
| ChEBI | 84069 |
| ChemSpider | 7772 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
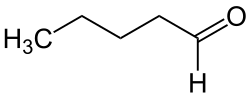
Пентана́ль (также называемый амиловым альдегидом или валериановым альдегидом) — это альдегид, молекулярная формула которого .
Физические свойства
Бесцветная летучая легкокипящая жидкость с сильным, резким запахом. Поскольку в молекулах карбонильных соединений водородных связей нет, то температура кипения у них будет значительно ниже, чем у соответствующих спиртов. В пентанале она будет равна 103 °С. Мало растворим в воде и хорошо растворим в органических растворителях (этанол, эфир и др.).
Химические свойства
Молярная масса составляет 86,13 г/моль.
Для пентаналя характерны:
- Реакции нуклеофильного присоединения
- Присоединение циановодородной кислоты
- Присоединение гидросульфитов
- Взаимодействие со спиртами
- Гидратация
- Присоединение реактивов Гриньяра
- Реакции полимеризации
- Реакции поликонденсации
- Окисление аммиачным раствором оксида серебра (реакция серебряного зеркала)
- Окисление гидроксидом меди
- Реакция Канниццаро
- Галогенирование
- Гидрирование: пентаналь способен присоединять водород, восстанавливаясь до пентанола
- Горение
Получение
Чаще всего пентаналь получают окислением пентанола оксидом меди, но также возможны и другие варианты.
Применение
Используется для получения пластмасс, конструкционного пластика, ароматизаторов. Также используется в медицине и ароматизации.
Примечания
- 1 2 3 4 5 6 http://www.cdc.gov/niosh/npg/npgd0652.html
- 1 2 3 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
Литература
- Дерябина Н.Е. Органическая химия. Книга 1. Углеводороды и их монофункциональные производные. — 2012.
- Глинка Н.Л. Общая химия. — 2010.