Гексакарбонилвольфрам
| Гексакарбонилвольфрам | |
|---|---|
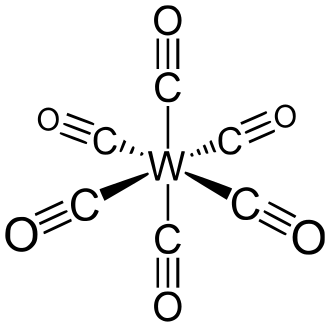 | |
 | |
| Общие | |
| Хим. формула | |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 351,91 г/моль |
| Плотность | 2,65 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 169 °C |
| • кипения | 175 °C |
| Классификация | |
| Рег. номер CAS | 14040-11-0 |
| PubChem | 98884 |
| Рег. номер EINECS | 237-880-2 |
| SMILES | |
| InChI | |
| ChemSpider | 89313 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ге́ксакарбони́лвольфра́́́м — неорганическое соединение, карбонильный комплекс вольфрама, химическая формула .
Получение
Действием монооксида углерода под давлением 200 атм на металлический вольфрам:
- .
Восстановлением раствора хлорида вольфрама(III) в эфире алюминием или железом в атмосфере монооксида углерода:
- .
Физические свойства
Гексакарбонилвольфрам образует бесцветные (белые) кристаллы ромбической сингонии, пространственная группа P 2nb, параметры ячейки a=1,127 нм, b=1,190 нм, c=0,642 нм, Z=4.
Не растворяется в воде.
Химические свойства
Разлагается при температуре выше 200°C:
- ,
- .
Окисляется концентрированной азотной кислотой:
Окисляется кислородом воздуха при кипячении в этаноле:
- .
- Реагирует с щелочами в присутствии кислорода:
- .
Применение
- Для получения вольфрамовых покрытий.
- В качестве катализатора.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю. Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.
