Гексахлороплатинат(IV) калия
| Гексахлороплатинат(IV) калия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гексахлороплатинат(IV) калия |
| Традиционные названия | гексахлороплатеат калия |
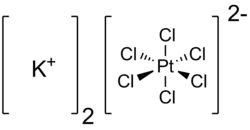
| Хим. формула | K2[PtCl6] |
| Физические свойства | |
| Состояние | светло-жёлтые кристаллы |
| Молярная масса | 485,99 г/моль |
| Плотность | 3,499 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разл. 250 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,4780; 0,77420; 3,7180; 5,03100 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,825 |
| Классификация | |
| Рег. номер CAS | 16921-30-5 |
| PubChem | 61856 |
| Рег. номер EINECS | 240-979-3 |
| SMILES | |
| InChI | |
| RTECS | TP1650000 |
| ChemSpider | 55728 и 8088921 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гексахлороплатинат(IV) калия — неорганическое соединение, комплексное соединение металла платины с формулой K2[PtCl6], светло-жёлтые кристаллы, плохо растворяется в воде.
Получение
- Реакция хлорида платины(IV) с концентрированным раствором хлорида калия:
- Реакция тетрахлороплатината(II) калия с хлором:
- Обменная реакция гексахлороплатината(IV) водорода:
- Реакция гексагидроксоплатината(IV) калия с соляной кислотой:
Физические свойства
Гексахлороплатинат(IV) калия образует светло-жёлтые кристаллы кубической сингонии, параметры ячейки a = 0,9745 нм.
Плохо растворяется в холодной воде.
Химические свойства
- Разлагается при нагревании:
- Реагирует с разбавленными щелочами:
- Реагирует с концентрированными щелочами:
- С концентрированным раствором аммиака реакция идёт иначе:
- Реагирует с сероводородом:
- Восстанавливается водородом:
- Восстанавливается платиновой чернью:
- Реагирует с концентрированным раствором цианистого калия:
Применение в органическом синтезе
- K2[PtCl6] был успешно использован в качестве катализатора в синтезе 1,4-дийодбута-1,3-диена из карбида кальция [1].
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- [1] A. N. Potorochenko, K. S. Rodygin, V. P. Ananikov, Eur. J. Org. Chem. 2024, 27, e202301012. https://doi.org/10.1002/ejoc.202301012