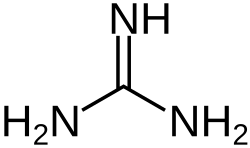
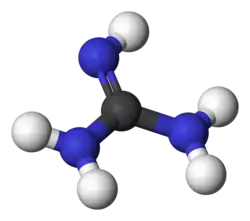
Гуанидин
| Гуанидин | |||
|---|---|---|---|
| |||
| Общие | |||
| Традиционные названия | гуанидин | ||
| Хим. формула | CH5N3 | ||
| Рац. формула | |||
| Физические свойства | |||
| Состояние | твёрдое в-во | ||
| Молярная масса | 59,07 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 50 °C | ||
| Энтальпия | |||
| • образования | −56,01 кДж/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 12,5 | ||
| Классификация | |||
| Рег. номер CAS | 113-00-8 | ||
| PubChem | 3520 | ||
| Рег. номер EINECS | 204-021-8 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 42820 | ||
| ChemSpider | 3400 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Гуаниди́н — органическое соединения с химической формулой . При нормальных условиях представляет собой бесцветное кристаллическое вещество, расплывается на воздухе вследствие поглощения влаги.
Является сильным однокислотным основанием pKa = 12,5. С HCl и HNO3 образует устойчивые соли.
История
Вещество было впервые получено окислительной деградацией природных ароматических продуктов, гуанина, выделенного из перуанского гуано[1].
Несмотря на простоту молекулы[2], кристаллическая структура была впервые описана на 148 лет позже открытия, в 2013 году положения атомов водорода в молекуле были точно определены с помощью нейтронографии монокристалла[3].
Нахождение в природе
Находится в моче преимущественно у пациентов с почечной недостаточностью как продукт метаболизма белков[4].
Свойства
Легко алкилируется. Обладает фунгицидной и бактерицидной активностью.
Получение
- В промышленности гуанидины получают сплавлением солей аммония с мочевиной или циангуанидином:
- .
- Также гидрированием циангуанидина на никеле Ренея:
- .
- Извлекают при помощи ионообменных смол из отходов производства мочевины.
- Карбонат извлекают из отходов производства меламина.
- Другие соли получают по реакции с основанием гуанидина.
- Спиртовые растворы при реакции хлорида гуанидиния с соответствующими алкоголятами.
Протонирование и основность
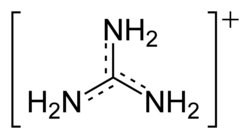
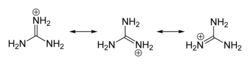
Гуанидин благодаря резонансной делокализации электрического заряда в симметричном гуанидиниевом катионе, образующимся при протонировании гуанидина, является сильным основанием сравнимым по силе (pKa = 13,5) с гидроксидом натрия.
Высокая основность характерна и для замещенных гуанидинов: так, гуанидиновая группа аминокислоты аргинина (pKa = 12,48) протонирована в физиологических условиях (при pH < 10).
Гуанидинхлорид используют для денатурации белков, причём концентрация и свободная энергия раскрытия находятся в линейной зависимости. С этой же целью используется и тиоцианат гуанидиния.
Производные гуанидина
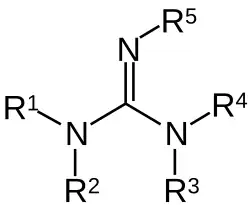
Гуанидины — группа органических соединений с общей структурой . Центральная связь внутри этой структуры — иминовая; другая распознаваемая субструктура — аминаль. Примеры гуанидинов: аргинин, триазобициклодецен и сакситоксин. Другие производные могут включать гуанидин гидроксид.
Гуанидиновые соли хорошо известны благодаря их денатурирующему действию на белки. Хлорид гуанидина — наиболее известный денатурант. В его 6 М растворе практически все белки с упорядоченой структурой теряют свою упорядоченность.
Бигуаниды — гипогликемические лекарственные средства, используемые при сахарном диабете. Молекулы бигуанидов состоят из полиметиленовой цепочки и гуанидиновой группы на обеих её концах.
Применение
- Соли гуанидина, применяемые в промышленности:
- динитрат — как взрывчатое вещество,
- нитрат — в качестве монотоплива,
- фосфат — в текстильной промышленности для придания огнеупорных свойств тканям,
- карбонат — в синтезе поверхностно-активных веществ и косметике для выпрямления волос.
- Продукт конденсации гуанидина с формальдегидом используется как ионообменная смола.
- Он также применяется в производстве пластмасс.
- В качестве перспективного альтернативного топлива[5].
- Нитрогуанидин, нитрат гуанидиния, перхлорат гуанидиния используют в качестве ракетного топлива.
- Хромат — ингибитор коррозии.
Безопасность
Токсичен, вызывает при попадании на кожу и в дыхательные пути химический ожог.
Примечания
- ↑ Strecker A. Liebigs Ann. Chem. 1861, 118, 151.
- ↑ Yamada T., Liu X., Englert U., Yamane H., Dronskowski R. Chem. Eur. J. 2009, 15, 5651.
- ↑ Sawinski PK, Meven M, Englert U, Dronskowski R (2013). Single-Crystal Neutron Diffraction Study on Guanidine, CN3H5. Crystal Growth & Design. 13 (4): 1730–5. doi:10.1021/cg400054k.
- ↑ Sawynok J, Dawborn JK (1975). Plasma concentration and urinary excretion of guanidine derivatives in normal subjects and patients with renal failure. Clinical and Experimental Pharmacology & Physiology. 2 (1): 1–15. doi:10.1111/j.1440-1681.1975.tb02368.x. PMID 1126056. S2CID 41794868.
- ↑ European Patent Office application EP20050746871 (недоступная ссылка).