Диэтилкарбонат
| Диэтилкарбонат[1][2] | |
|---|---|
 | |
| Общие | |
| Сокращения | DEC |
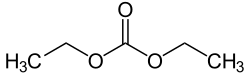
| Хим. формула | C5H10O3 |
| Физические свойства | |
| Молярная масса | 118,13 г/моль |
| Плотность | 0,975 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | −43 °C[3][4] |
| • кипения | 127 °C |
| • вспышки | 25 °C |
| Структура | |
| Дипольный момент | 3,7E−30 Кл·м[4] |
| Классификация | |
| Рег. номер CAS | 105-58-8 |
| PubChem | 24894264 |
| Рег. номер EINECS | 203-311-1 |
| SMILES | |
| InChI | |
| ChEBI | 173463 |
| ChemSpider | 7478 |
| Безопасность | |
| Краткие характер. опасности (H) |
H226, H315, H319, H335 |
| Меры предостор. (P) |
P261, P305+P351+P338 |
| Сигнальное слово | Осторожно |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Диэтилкарбонат — органическое вещество, сложный эфир угольной кислоты и этанола. В органическом синтезе используется преимущественно как электрофильный реагент для введения этоксикарбонильной группы в соединения.
Строение и физические свойства
Диэтилкарбонат представляет собой бесцветную жидкость. Он смешивается со спиртами, сложными эфирами, простыми эфирами. Нерастворим в воде[1].
Химические свойства и применение
Диэтилкарбонат применяется в органическом синтезе как электрофильный реагент для введения этоксикарбонильной группы. Енолят-ионы, с которыми он реагирует, принято генерировать добавлением к соединениям с подвижным протоном таких оснований, как гидрид натрия (иногда в смеси с гидридом калия), алкоголяты, диизопропиламид лития. Последнее из перечисленных оснований является особенно подходящим, поскольку оно превращает субстрат в енолят-ион нацело и исчезает вероятность протекания реакции енолят-иона с оставшимся субстратом[1].
Так, кетоны можно превратить в β-кетоэфиры, а затем — при повторном этоксикарбонилировании — в малонаты. Также подобной реакции подвергаются арил- и алкилцианиды, нитросоединения и изонитрилы. Этоксикарбонилировать можно и карбоновые кислоты: в этом случае образуются моноэфиры малоновых кислот, а использовать необходимо два эквивалента основания. Диэтилкарбонат вступает во взаимодействие с реактивами Гриньяра, образуя сложные эфиры[1].
Также в реакцию этоксикарбонилирования с участием диэтилкарбоната вступают анионы, полученные прямым металлированием ароматических соединений. Амины и гидразины вступают в реакцию с диэтилкарбонатом, давая соответствующие карбаматы и карбазаты[1].
В некоторых описанных примерах диэтилкарбонат выступает как двухвалентный реагент и взаимодействует с двумя эквивалентами литийорганического реагента, давая симметричный кетон[1].
Примечания
- 1 2 3 4 5 6 EROS, 2015.
- ↑ Diethyl carbonate (англ.). Sigma-Aldrich. Дата обращения: 7 января 2020.
- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
Литература
- Diethyl Carbonate (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2015. — doi:10.1002/047084289X.rd180.pub2.
Ссылки
- ЯМР-спектр диэтилкарбоната. Sigma-Aldrich. Дата обращения: 29 июля 2019.
- ИК-спектр диэтилкарбоната. Sigma-Aldrich. Дата обращения: 29 июля 2019.
- КР-спектр диэтилкарбоната. Sigma-Aldrich. Дата обращения: 29 июля 2019.