Иодид мышьяка(III)
| Иодид мышьяка(III) | |
|---|---|
 | |
 | |
| Общие | |
| Хим. формула | AsI3 |
| Внешний вид | оранжево-красное кристаллическое твердое вещество |
| Физические свойства | |
| Молярная масса | 455.635 г/моль |
| Плотность | 4.69 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 146 °C |
| • кипения | 403 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 6 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 2.23 |
| Классификация | |
| Рег. номер CAS | 7784-45-4 |
| PubChem | 24575 |
| Рег. номер EINECS | 232-068-4 |
| SMILES | |
| InChI | |
| RTECS | CG1950000 |
| ChemSpider | 22979 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
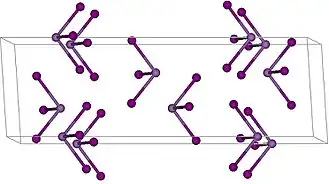
Иодид мышьяка(III) AsI3 — химическое соединение мышьяка с иодом. Молекула пирамидальной формы, с ковалентной связью[1].
Свойства
Иодид мышьяка(III) представляет собой оранжево-красные или рубиново-красные кристаллы гексагональной сингонии, а в расплавленном виде — коричнево-красная жидкость. Растворяется в воде с гидролизом, этаноле, диэтиловом эфире, сероуглероде, бензоле.
Гидролиз происходит медленно, с образованием триоксида мышьяка и иодоводородной кислоты. Промежуточным продуктом реакции является As(OH)3, находящийся в равновесии с иодоводородной кислотой.
Реакция водного раствора сильнокислая, pH 0,1 н раствора в составляет 1,1. При прокаливании на воздухе (200 °C) разлагается с образованием триоксида мышьяка, иода и мышьяка в свободном виде.
С иодидами щелочных металлов (KI, RbI, CsI) образует иодоарсенаты(III) с общей формулой M3[As2I9]
Получение и применение
Иодид мышьяка(III) получают прямой реакцией мышьяка с иодом в среде сероуглерода, по реакции трихлорида мышьяка и иодийной соли активного металла (например, калия) в сильнокислом растворе:
Используется в производстве полупроводниковых материалов из мышьяка.
Ранее применялся в медицине для лечения ревматизма, артрита, малярии, трипанасомных инфекций, туберкулёза и диабета.[2]
Примечания
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ↑ Shakhashiri BZ, «Chemical of the Week: Arsenic» Архивная копия от 2 августа 2008 на Wayback Machine, University of Wisconsin-Madison Chemistry Dept. (англ.) (Дата обращения: 21 июня 2009)
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.