Карнегин
| Карнегин | |
|---|---|
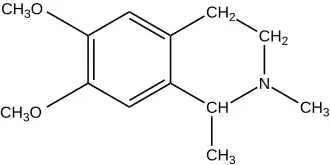 | |
| Общие | |
| Хим. формула | C13H19NO2 |
| Физические свойства | |
| Молярная масса | 221,29 г/моль |
| Термические свойства | |
| Температура | |
| • кипения | 170 °C |
| Классификация | |
| Рег. номер CAS | 490-53-9 |
| PubChem | 22646 |
| SMILES | |
| InChI | |
| ChemSpider | 21227 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карнегин (пектенин) — алкалоид тетрагидроизохинолинового ряда. Выделен в 1901 г. из произрастающего в Мексике кактуса Cereus pecten aboriginum Engelm и в 1928 г. — из кактуса Карнегия (Carnegia gigantea), по которому и получил своё название[1][2].
Представляет собой густое масло, кипящее при 170 °C. Не обладает оптической активностью. Образует хорошо кристаллизующиеся соли и моноиодметилат.
Синтез
Синтез возможен из 3,4-диметоксифенетиламина. Он циклизуется с уротропином. Затем происходит асимметричное гидроцианирование в положении 1 и защита амина трифторацетильной группой. Гидролиз и этерификация метанолом превращают нитрил в метиловый эфир карбоновой кислоты, при этом трифторацетильная группа отщепляется. Аминогруппа защищена карбоксибензильной группой, а сложный эфир восстанавливается алюмогидридом лития до гидроксиметильной группы, которая затем тозилируется. Дальнейшая реакция с алюмогидридом лития дает метильную группу. После снятия защиты триметилсилилтрифлатом образуется сальсолидин, который при реакции с формальдегидом в ацетонитриле и восстановлении цианоборогидридом натрия дает карнегин[3].
Другой, также энантиоселективный синтез основан на ключевом этапе сопряжённого присоединения по Михаэлю фенилэтиламина к хиральному этинилсульфоксиду[4].
Литература
- Орехов А. П. Химия алкалоидов. 2-е изд., испр. и доп. д-ром хим. наук Р. А. Коноваловой и канд. хим. наук А. А. Коноваловой. — М.: Изд-во Акад. наук СССР, 1955. — 860 с.
Примечания
- ↑ S. D. Brown, J. E. Hodgkins, J. L. Massingill, M. G. Reinecke. Isolation, structuer, synthesis, and absolute configuration of the cactus alkaloid gigantine (англ.) // The Journal of Organic Chemistry. — 1972-06. — Vol. 37, iss. 11. — P. 1825–1828. — ISSN 0022-3263. — doi:10.1021/jo00976a034. Архивировано 23 января 2025 года.
- ↑ Орехов А. П. Химия алкалоидов / испр. и доп. д-ром хим. наук Р. А. Коноваловой и канд. хим. наук А. А. Коноваловой. — Академия наук СССР, 1955. — С. 269—270. — 869 с.
- ↑ Takuya Kanemitsu, Yuki Yamashita, Kazuhiro Nagata, Takashi Itoh. Catalytic Asymmetric Synthesis of ( R )-(-)-Calycotomine, ( S )-(-)-Salsolidine and ( S )-(-)-Carnegine (англ.) // Synlett. — 2006-06. — Vol. 2006, iss. 10. — P. 1595–1597. — ISSN 0936-5214. — doi:10.1055/s-2006-941586. Архивировано 2 июня 2018 года.
- ↑ Winghong Chan, Albert W. M. Lee, Lasheng Jiang. Chiral acetylenic sulfoxides in organic synthesis: Secondary amine cyclization and total synthesis of (S)-(−)-carnegine // Tetrahedron Letters. — 1995-01-30. — Т. 36, вып. 5. — С. 715–718. — ISSN 0040-4039. — doi:10.1016/0040-4039(94)02323-4.