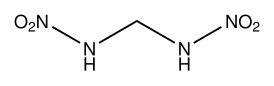
Метилендинитрамин
| Метилендинитрамин | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
N-(нитрамидметил)нитрамид |
| Традиционные названия | Медина |
| Хим. формула | CH4N4O4 |
| Рац. формула | CH2(NHNO2)2 |
| Физические свойства | |
| Состояние | Кристаллическое |
| Молярная масса | 136,02 г/моль |
| Плотность | 1,74 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 101 °C |
| Классификация | |
| Рег. номер CAS | 14168-44-6 |
| PubChem | 26524 |
| SMILES | |
| InChI | |
| ChEBI | 25296 |
| ChemSpider | 24707 |
| Безопасность | |
| ЛД50 | 190 мг/кг (крыса внутрибрюшинный маршрут) |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Метилендинитрамин (МЕДИНА) или N,N'-динитрометандиамин — взрывчатое химическое вещество, представитель нитраминов. Является простейшим представителем динитраминов[1].
История
Впервые метилендинитрамин был получен в ходе исследований по получению гексогена из уротропина британским химиком Эдмундом Хирстом в 1951 году[1].
Получение
Первый открытый способ получения метилендинитрамина включал нитрирование уротропина при температуре −40 °С и последующий щелочной гидролиз полученного нитрата 3,5-динитрогексагидро-1,3,5-триазина с помощью гидроксида бария. При этом получается бариевая соль митилендинитрамина. Чтобы получить вещество в чистом виде, соль подкисляют в слабой кислоте.

Его также можно получить аналогичным способом, используя N,N′-метилендиацетамид.
Более современный метод основан на реакции формальдегида с N,N-динитромочевиной в присутствии серной кислоты при 20-80°С.
Физические свойства
Метилендинитрамин представляет собой белые кристаллы с ромбической структурой. Нестабилен при механическом и химическом воздействии. Скорость детонации составляет 8700 м/с, а фугасность, измеренная в бомбе Трауцля, составляет ±700 см3[1][2].
Химические свойства
Является слабой кислотой. Обладает схожими свойствами с нитраминами. Его ближайшим аналогом является этилендинитрамин (ЭДНА)
Под влиянием сильных кислот и щелочей (рН 3-8) гидролизуется. Максимальная скорость гидролиза наблюдается при рН 5,41.
Разложение вещества следует уравнению:
Считается, что разложение ускоряет формальдегид. Он же и является основным продуктом реакции[4].
Реагирует с щелочами. Образует соли со щелочными и щелочноземельными металлами, а также с аминами (включая метиламин и гидразин). Все соли с металлами относительно стабильны и не разлагаются при нормальных условиях.
Применение
Раньше метилендинитрамин использовали как взрывчатое вещество. Именно поэтому его разложение детально изучено.
Метилендинитрамин применяют в синтезе сложных циклических азотсодержащих соединений. Например для синтеза 1,5-динитро-1,3,5,7-тетраазациклооктана.

Метилендинитрамин также может быть использован для получения полиметиленнитраминов, которые полезны в качестве термостойких и высокоэнергетических полимеров. При нагревании в диметилсульфоксиде происходит реакция переноса нитрометиленовой группы с образованием 1,3,5-тринитро-1,3,5-триазапентана.

Примечания
- 1 2 3 Метилендинитрамин - Справочник химика 21. chem21.info. Дата обращения: 30 марта 2025. Архивировано 24 апреля 2025 года.
- 1 2 Władysław Paweł Cetner. Preparatyka materiałów wybuchowych i produktów pośrednich (пол.). — Варшава: Военная техническая академия им. Ярослава Домбровского, 1986. — С. 111-117.
- ↑ Введение. StudFiles. Дата обращения: 27 марта 2025. Архивировано 24 апреля 2025 года.
- ↑ Александр Михайлович Астахов. Термическое разложение первичных нитраминов в конденсированном состоянии // disserCat. — 1999. Архивировано 24 апреля 2025 года.
