Метилциклогексан
| Метилциклогексан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Метилциклогексан | ||
| Традиционные названия | Гексагидротолуол | ||
| Хим. формула | C7H14 | ||
| Физические свойства | |||
| Молярная масса | 98,19 г/моль | ||
| Плотность | 0,77 г/см³ | ||
| Энергия ионизации | 9,85 ± 0,01 эВ[1] и 9,64 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −126,3 °C | ||
| • кипения | 101 °C | ||
| • вспышки | 25 ± 1 ℉[1] | ||
| Пределы взрываемости | 1,2 ± 0,1 об.%[1] | ||
| Энтальпия | |||
| • образования | −154 770 Дж/моль[3] и −190 160 Дж/моль[3] | ||
| Давление пара | 37 ± 1 мм рт.ст.[1] | ||
| Классификация | |||
| Рег. номер CAS | 108-87-2 | ||
| PubChem | 7962 | ||
| Рег. номер EINECS | 203-624-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | GV6125000 | ||
| ChEBI | 165745 | ||
| ChemSpider | 7674 | ||
| Безопасность | |||
| ЛД50 | 2250 мг/кг | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
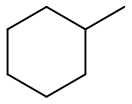
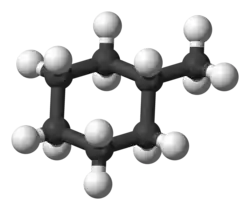
Метилциклогексан (гексагидротолуол) — органическое вещество класса циклоалканов с химической формулой C7H14.
Строение
По своему строению метилциклогексан относится к моноциклическим углеводородам со средним размером цикла. Он представляет собой циклогексан, у которого один атом водорода замещён метильной группой[4].
Данное вещество существует в конформации кресла. Такая конформация наиболее симметрична, и каждый атом углерода в цикле имеет по две неэквивалентные связи C−H. Связи, которые расположенный параллельно вертикальной оси симметрии третьего порядка — аксиальные, а те, что ориентированы под углом 109,5° относительно оси — экваториальные. В равновесной смеси конформаций данного соединения 95% молекул находится в экваториальной конформации, а остальные — в аксиальной[5].
Свойства
Метилциклогексан — бесцветная жидкость с температурой кипения 101 °С, температурой плавления −126,3 °С и плотностью 0,77 г/см3[6].
По химическим свойствам гексагидротолуол похож на алкан. Он может вступать в реакции галогенирования, нитрования, сульфохлорирования и др. В реакции окисления вступает только в жёстких условиях, образуя соответствующий циклический спирт, кетон или дикарбоновую кислоту (в случае разрыва цикла). В присутствии катализаторов дегидрируется с образованием толуола[7]:
Получение
Углеводород был впервые получен в 1876 году Ф. Р. Вреденом путём гидрирования толуола иодоводородом.[8]
Метилциклогексан содержится в нефтепродуктах и выделяется из них в промышленном масштабе. Также возможно его получение каталитическим гидрированием толуола[9]:
Примечания
- 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0406.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- 1 2 Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics (англ.) // Journal of Chemical Education — ACS, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
- ↑ Белобородов В. Л., Зурабян С. Э., Лузин А. П., Тюкавкина Н. А., 2003, с. 171.
- ↑ Белобородов В. Л., Зурабян С. Э., Лузин А. П., Тюкавкина Н. А., 2003, с. 114—115.
- ↑ 108-87-2 Methylcyclohexane Архивная копия от 6 октября 2018 на Wayback Machine.
- ↑ Белобородов В. Л., Зурабян С. Э., Лузин А. П., Тюкавкина Н. А., 2003, с. 178—179.
- ↑ Феликс Романович Вреден - Биография. physchem.chimfak.sfedu.ru. Дата обращения: 3 декабря 2024. Архивировано 13 декабря 2024 года.
- ↑ Белобородов В. Л., Зурабян С. Э., Лузин А. П., Тюкавкина Н. А., 2003, с. 174—177.
Литература
- Белобородов В. Л., Зурабян С. Э., Лузин А. П., Тюкавкина Н. А. Органическая химия / под ред. Тюкавкиной Н. А. — М.: Дрофа, 2003. — Т. 1. — 640 с. — ISBN 5-7107-7589-4.