Моноиодацетат натрия
Моноиодацетат натрия[1] | |
|---|---|
 | |
Общие | |
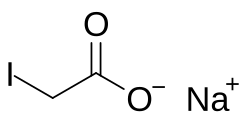
| Хим. формула | C₂H₂INaO₂ |
Физические свойства | |
| Состояние | светло-жёлтый порошок |
| Молярная масса | 207,93 г/моль |
Термические свойства | |
| Т. плав. | 208 °C, разл. |
| Т. всп. | 112,3 ℃ |
| Энтальпия кипения | 55,03 |
Классификация | |
| Номер CAS | 305-53-3 |
| PubChem | 5239 |
| ChemSpider | 5049 |
| Номер EINECS | 206-165-7 |
| RTECS | AI3675000 |
C(C(=O)[O-])I.[Na+] | |
InChI=1S/C2H3IO2.Na/c3-1-2(4)5;/h1H2,(H,4,5);/q;+1/p-1 | |
Безопасность | |
| ЛД50 | 83 мг/кг (мыши, перорально) |
| Токсичность | повреждение печени, ДНК |
| R-фразы | R25, R37/38, R41 |
| S-фразы | S26, R39, R45 |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Моноиодацетат натрия — органическое соединение, соль натрия и моноиодуксусной кислоты с химической формулой C2H2INaO2.
Моноиодуксусная кислота и её соли являются сильными метаболическими ядами. Моноиодацетат необратимо связывается с группой -SH цистеина и тем самым нарушает активность ферментов в метаболических путях, например, прерывает гликолиз.
Получение
Соединение, не загрязненное ионами галогена, можно получить из монохлоруксусной кислоты и иодида натрия в среде ацетона с последующим подщелачиванием до pH 6.8 раствором гидроксида натрия. Выход реакции около 91 %[2].
Примечания
- ↑ Sigma-Aldrich. Sodium iodoacetate, ≥98% (англ.). Дата обращения: 16 марта 2014.
- ↑ Goldberg, 1943.
Литература
- Goldberg, L. The preparation of the sodium iodoacetate (англ.) // Science : журнал. — American Association for the Advancement of Science, 1943. — 29 октябрь (т. 98, № 2548). — С. 386. — doi:10.1126/science.98.2548.386.
Ссылки
- Sigma-Aldrich. ИК-спектр моноиодацетата натрия (конденсированная фаза). Дата обращения: 16 марта 2014.
- Sigma-Aldrich. КР-спектр моноиодацетата натрия. Дата обращения: 16 марта 2014.