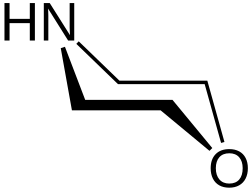
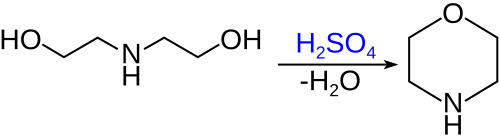Морфолин
| Морфолин | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
тетрагидрооксазин-1,4 | ||
| Традиционные названия | морфолин | ||
| Хим. формула | C4H9NO | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 87,1 г/моль | ||
| Плотность | 1,007 г/см³ | ||
| Динамическая вязкость | 2,02 мПа·с[1], 1,247 мПа·с[1], 0,85 мПа·с[1] и 0,627 мПа·с[1] | ||
| Энергия ионизации | 8,2 эВ[2] и 8,88 эВ[3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -5 °C | ||
| • кипения | 129 °C | ||
| • вспышки | 31 °C[4], 98 ℉[3] и 37 °C[5] | ||
| • самовоспламенения | 275 °C[4] и 290 °C[5] | ||
| Пределы взрываемости | 1,4 об.%[3][5] и 1,8 об.%[4] | ||
| Давление пара | 10,7 гПа[4], 799,93 Па[3], 1,34 кПа[6], 16 гПа[4] и 51,7 гПа[4] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 8,33 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Оптические свойства | |||
| Показатель преломления | 1,4545 | ||
| Структура | |||
| Дипольный момент | 1,58 Д | ||
| Классификация | |||
| Рег. номер CAS | 110-91-8 | ||
| PubChem | 8083 | ||
| Рег. номер EINECS | 203-815-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | QD6475000 | ||
| ChEBI | 34856 | ||
| ChemSpider | 13837537 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м³ | ||
| ЛД50 | 15-100 мг/кг | ||
| Токсичность | Класс опасности 2 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
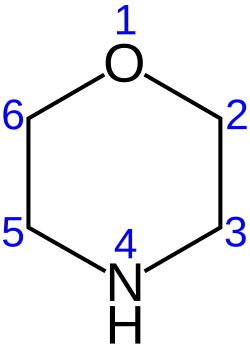
Морфоли́н — гетероциклическое соединение (тетрагидрооксазин-1,4). Химическая формула HN(CH2CH2)2O.
Используется в органическом синтезе как катализатор в качестве основания (акцептор протона), в частности, для получения геминальных дитиолов.
История
Морфолин впервые синтезировал в 1889 году немецкий химик-органик Людвиг Кнорр и он же дал веществу название, ошибочно полагая, что эта структурная единица входит в молекулу морфина[7].
Физические свойства
Бесцветная гигроскопичная жидкость со слабым аминным запахом рыбы.
Смешивается с водой, ацетоном, диэтиловым эфиром.
Молекула морфолина имеет конформацию в виде «кресла».
Химические свойства
Морфолин вступает в большинство реакций, характерных для вторичных аминов. Благодаря атому кислорода, оттягивающего электронную плотность на себя от атома азота, он менее нуклеофильный и менее основный, чем структурно аналогичный вторичный амин, такой как, например, пиперидин. Поэтому он образует стойкий хлорамин[8].
Получение
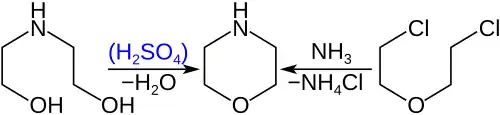
Морфолин получают дегидратацией диэтаноламина[9]
или аминированием бис(2-хлорэтилового)эфира:
Очистка
Для очистки его сушат над сернокислым кальцием, после чего с осторожностью дробно перегоняют. Рекомендуют также перегонку или высушивание над металлическим натрием[10], либо высушивание над гидроксидом калия (KOH), перегонкой, выдерживанием над металлическим натрием и повторной перегонкой[11].
Применение
В промышленности
Морфолин — ингибитор коррозии. Морфолин — обычная добавка с концентрацией в миллионных долях, для регулирования pH как в топливных системах с использованием минеральных топлив, так и в системах охлаждения ядерных реакторов. С этой целью морфолин применяется из-за его летучести близкой к летучести воды, то есть, при добавлении морфолина в воду, его концентрации в воде и парах примерно одинаковы и он распространяется вместе с водяным паром через весь парогенератор, обеспечивая регулирование pH и защиту от коррозии.
Морфолин достаточно устойчив и медленно разлагается в отсутствие кислорода при высоких температурах и давлениях в парогенераторах.
Используется в качестве абсорбента для очистки газов от CS2 и карбонилсульфида (COS).
Органический синтез
Морфолин широко используется в органическом синтезе. Например, его фрагмент входит в структуру антибиотика линезолида и противоракового препарата Gefitinib.
Он также широко используется для получения енаминов[12].
Морфолин используется в качестве амина в модификации Киндлера реакции Вильгеродта для получения ω-арилалкановых кислот[13][14][15].
В исследованиях и в промышленности, дешевизна и полярные свойства морфолина привела к его широкому применению в качестве растворителя для реагентов химических реакций.
Безопасность
Морфолин — легковоспламеняющаяся жидкость. Температура вспышки 35 °С, температура самовоспламенения 230 °С. Пары раздражают слизистые оболочки дыхательных путей, при попадании на кожу вызывают жжение. ЛД50 15-100 мг/кг (мыши и морские свинки, перорально); ПДК 0,5 мг/м3[16][17].
Примечания
- 1 2 3 4 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—246. — ISBN 978-1-4987-5428-6
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0437.html
- 1 2 3 4 5 6 Morpholine
- 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 16—27. — ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 15—18. — ISBN 978-1-4987-5428-6
- ↑ F. Silversmith, Ernest; Nickon, Alex. Organic Chemistry : Modern Coined Terms and Their Origins (англ.). — Elsevier Science, 2013. — P. 313. — ISBN 978-1483145235.
- ↑ Lindsay Smith, J. R.; McKeer L. C.; Taylor J. M. (1993), «4-Chlorination of Electron-Rich Benzenoid Compounds: 2,4-Dichloromethoxybenzene», Org. Synth.; Coll. Vol. 8: 167
- ↑ Малиновский М. С. Окиси олефинов и их производные. М., Госхимиздат, 1961, стр. 253.
- ↑ Гордон А., Форд Р. Спутник химика.//Перевод на русский язык Розенберга Е. Л., Коппель С. И. Москва: Мир, 1976. — 544 с.
- ↑ Perrin D. D.; Armarego W. L. F. Purification of Laboratory Chemicals, 3rd ed.; Pergamon: Oxford, 1988; p 233.
- ↑ Noyori R.; Yokoyama K.; Hayakawa Y. (1988), «Cyclopentenones from α,α'-Dibromoketones and Enamines: 2,5-Dimethyl-3-Phenyl-2-Cyclopenten-1-one», Org. Synth.; Coll. Vol. 6: 520
- ↑ Кнунянц Л. И. Химическая энциклопедия, М. 1988, т. 1, стр. 366
- ↑ Newman M. S.; Lowrie H. S. Journal American Chemical Society 1954, 76, p. 6196.
- ↑ Mayer R.; Wehl J. AG(E) 1964, 3, 705.
- ↑ Гетероциклические соединения. Под ред. Р. Эльдерфилда, пер. с англ., т. 6, М., 1960, с. 409—425
- ↑ Карпейский А. М. Общая органическая химия. Пер. с англ., т. 3, М., 1982, с. 144.