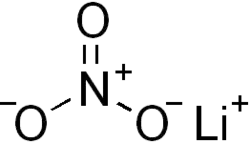
Нитрат лития
| Нитрат лития | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
нитрат лития |
| Хим. формула | LiNO3 |
| Физические свойства | |
| Состояние | белое твердое |
| Молярная масса | 68,946 г/моль |
| Плотность | 2,38 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 255 °C |
| • кипения | > 600 °C (разлагается) °C |
| Энтальпия | |
| • образования | -483,104 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
90 г/100 мл (28 °C) 234 г/100 мл (100 °C) |
| Оптические свойства | |
| Показатель преломления | 1,735 [1] |
| Классификация | |
| Рег. номер CAS | 7790-69-4 |
| PubChem | 10129889 и 23669630 |
| Рег. номер EINECS | 232-218-9 |
| SMILES | |
| InChI | |
| RTECS | QU9200000 |
| ChEBI | 63315 |
| ChemSpider | 8305408 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат лития — соль щелочного металла лития и азотной кислоты с формулой LiNO3. Эта гигроскопичная соль используется в пиротехнике для придания пламени красного цвета. Образует кристаллогидрат LiNO3·3H2O.
Получение
- Нитрат лития можно получить по реакции карбоната лития[2] или гидроксида лития[3] с азотной кислотой:
Li2CO3 + 2 HNO3 → 2 LiNO3 + CO2 + H2O
LiOH + HNO3 → LiNO3 + H2O
- Также взаимодействием металлического лития или его оксида с азотной кислотой:
21Li + 26HNO3 → 21LiNO3 + NO↑ + N2↑ + N2O↑ + 13H2O
Li2O + 2HNO3 → 2LiNO3 + H2O
- Взаимодействие лития с азотной кислотой:
8Li + 10HNO3 → 8LiNO3 + N2O+5H2O
Свойства
При термическом разложении LiNO3 образует оксид лития (Li2O), диоксид азота и кислород:
- 4 LiNO3 → 2 Li2O + 4 NO2 + O2
Нитраты других щелочных металлов разлагаются иначе, с образованием нитритов и кислорода. Это объясняется относительно малым размером катиона лития, который является сильно поляризующим, что способствует образованию оксида при разложении.
Примечания
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1154.
- ↑ D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 228
Ссылки
- Hazardous Chemical Database (недоступная ссылка)

