Нитрат ртути(II)
| Нитрат ртути(II) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Нитрат ртути(II) |
| Традиционные названия | Азотнокислая ртуть |
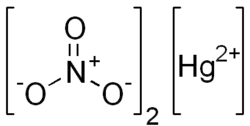
| Хим. формула | Hg(NO3)2 |
| Физические свойства | |
| Молярная масса | 324,30 г/моль |
| Плотность | гидр. 4,30 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 79 °C |
| Классификация | |
| Рег. номер CAS | 10045-94-0 |
| PubChem | 16683796 и 24864 |
| Рег. номер EINECS | 233-152-3 |
| SMILES | |
| InChI | |
| RTECS | OW8225000 |
| Номер ООН | 1625 |
| ChemSpider | 23247 и 48056839 |
| Безопасность | |
| Токсичность | токсично |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т рту́ти(II) — неорганическое соединение, соль металла ртути и азотной кислоты с формулой Hg(NO3)2, бесцветные кристаллы, растворимые в кислых водных растворах, высокотоксичен, гидролизуется горячей водой, образует кристаллогидраты.
Получение
- Растворение ртути в горячей концентрированной азотной кислоте:
- или оксида ртути в разбавленной азотной кислоте:
- Окисление нитрата ртути(I) горячей концентрированной азотной кислотой:
- или кислородом в разбавленной азотной кислоте:
- Реакция ртути с оксидом азота:
Физические свойства
Нитрат ртути(II) образует бесцветные кристаллы.
Растворим в подкисленной холодной воде, гидролизуется в горячей воде. Растворяется в ацетоне.
Образует кристаллогидраты состава Hg(NO3)2•n H2O, где n = ½, 1, 2, 8.
Химические свойства
- Безводную соль получают сушкой кристаллогидрата в вакууме:
- Разлагается при нагревании:
- Реагирует с водой:
- Реагирует с щелочами:
- Вступает в обменные реакции:
- В разбавленной азотной кислоте обратимо реагирует со ртутью:
Применение
- Как реактив в химическом анализе.
- В органическом синтезе.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.

