Нитрат скандия
| Нитрат скандия | |
|---|---|
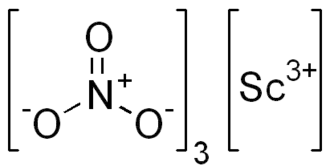 | |
| Общие | |
| Систематическое наименование |
Нитрат скандия |
| Традиционные названия | Азотнокислый скандий |
| Хим. формула | Sc(NO3)3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 230,97 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 150 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 77,425 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13465-60-6 |
| PubChem | 166818 |
| Рег. номер EINECS | 236-701-5 |
| SMILES | |
| InChI | |
| ChemSpider | 145950 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат скандия — неорганическое соединение, соль металла скандия и азотной кислоты с формулой Sc(NO3)3, бесцветные кристаллы, расплываются на воздухе, растворимые в воде, образует кристаллогидрат.
Получение
- Растворение металлического скандия в очень разбавленной азотной кислоте:
- Растворение оксида или гидроксида скандия в азотной кислоте:
- Реакция диоксида азота с металлическим скандием:
Физические свойства
Нитрат скандия образует бесцветные (белые) кристаллы, которые расплываются на воздухе.
Хорошо растворяется в воде с гидролизом по катиону.
Образует кристаллогидрат состава Sc(NO3)3•4H2O.
Химические свойства
- Разлагается при нагревании:
- Кристаллогидрат при нагревании разлагается иначе:
- Реагирует с щелочами:
- Реагирует с карбонатами щелочных металлов:
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.