Нитрат тригидразинникеля(II)
Нитрат тригидразинникеля(II) | |
|---|---|
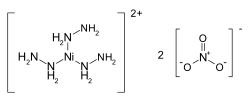 | |
 | |
Общие | |
| Традиционные названия | Никель гидразин нитрат, нитрат гидразина-никеля |
| Хим. формула | H12N8NiO6 |
| Рац. формула | [Ni(N2H4)3](NO3)2 |
Физические свойства | |
| Состояние | твёрдое вещество яркого сиреневого цвета |
| Молярная масса | 278,84 г/моль |
| Плотность | 2,1 г/см³ |
Химические свойства | |
| Растворимость в воде | нерастворим |
| Растворимость в этаноле, изопропаноле, диэтиловом эфире | нерастворим |
Классификация | |
| Номер CAS | 69101-54-8 |
Безопасность | |
| Токсичность | ядовит |
| Сигнальное слово | Опасно |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Нитра́т тригидрази́нни́келя(II) (никель гидразин нитрат) — комплексное соединение никеля, гидразина и нитрат-ионов. Обладает взрывчатыми свойствами.
Физические свойства
Нитрат тригидразинникеля(II) представляет собой твёрдое вещество яркого сиреневого цвета. Обладает взрывчатыми свойствами, находится между инициирующими и бризантными взрывчатыми веществами, что делает возможным использование вещества в детонаторах.[1] По отношению к иными взрывчатым веществам, например, азиду свинца, имеет в десятки раз большую устойчивость к трению.
Нерастворим в воде, этаноле, изопропаноле и диэтиловом эфире.[2]
Химические свойства
Теоретической реакцией внутримолекулярного окисления-восстановления выступает восстановление никеля(II) до никеля(0) и конпропорционирование азота до N2:
Реакция разложения сопровождается взрывом. Прохождение именно вышеуказанной реакции доказывается выделением никелевой пыли при взрыве.
Вещество растворяется в концентрированной азотной кислоте с образованием синего или зелёного раствора, что, по-видимому, связанно с сильным протонированием лиганда:
Безопасное уничтожение вещества может быть достигнуто растворением его в азотной кислоте и последующим окислением гидразина. Для полноты реакции подходят лишь наиболее активные и сильные окислители, например, перманганаты, дихроматы, хлор (реакции для простоты указаны для чистого гидразина N2H4, однако в растворе на самом деле находятся различные протонированные формы):
Запись реакций с самим соединением:
О полноте прохождения реакции можно судить по прекращению выделения азота.
Получение
Нитрат тригидразинникеля(II) получается при смешивании нагретых водных растворов нитрата никеля(II) и гидразина:[3]
А также при смешивании растворов, содержащих свободные ионы Ni2+, NO3-, и гидразин. Полученный таким образом препарат имеет талькоподобный вид. Свободные кислоты в растворе до некоторых концентрации почти не мешают прохождению реакции. Добавление некоторого количества декстрина (от 0.1 до 1 % масс.) позволяет увеличить насыпную плотность с 0.9 г/см3 до 1.2 г/см3.[2]
Безопасность
Опасность вещества исходит из взрывоопасности и ядовитости. Вещество взрывоопасно, однако не чрезвычайно чувствительно. Находится на границе бризантных и инициирующих ВВ. Восприимчиво к ударам, поджогу, искрам.[2] Соединения никеля и никелевая пыль считаются соединениями I класса опасности по ГОСТ 12.1.007—76 (чрезвычайно опасное вещество). Газовая смесь, образующаяся при взрыве смертельно ядовита, канцерогенна.[4]
Примечания
- ↑ Hariharanath, B.; Chandrabhanu, K. S.; Rajendran, A. G.; Ravindran, M.; Kartha, C. B. Detonator using Nickel Hydrazine Nitrate as Primary Explosive // Defence Science Journal. — 2006.
- 1 2 3 Nickel hydrazine nitrate (англ.). Sciencemadness Wiki.
- ↑ Chhabra, J.S; Talawar, M.B; Makashir, P.S; Asthana, S.N; Singh, Haridwar. Synthesis, characterization and thermal studies of (Ni/Co) metal salts of hydrazine: Potential initiatory compounds (англ.) // Journal of Hazardous Materials. — 2003.
- ↑ ICSC 0062 - NICKEL (англ.). International Chemical Safety Cards. International Labour Organisation. Дата обращения: 24 ноября 2024.
