Нитрат цинка
| Нитрат цинка | |
|---|---|
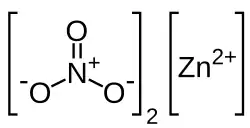 | |
| | |
| Общие | |
| Систематическое наименование |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Хим. формула | |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 12825; 125073 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES | |
| InChI | |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Безопасность | |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т ци́нка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой , бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
Кристаллогидраты вещества получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
- ;
- ;
- .
Безводную соль невозможно получить приведёнными реакциями, её получают реакцией металлического цинка с раствором диоксида азота в ацетонитриле:
- .
Основной производитель в мире — США. Объёмы промышленного производства вещества в США за 2019 год составили более 1850 тонн.
Физические свойства
2_dans_eau-ru.svg.png)
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава , где = 1, 2, 4, 6 и 9.
Химические свойства
Разлагается при нагревании более 250 °C на оксид цинка, оксиды азота и кислород.
- .
Вступает в реакции ионного обмена:
- .
Проявляет амфотерные свойства, вступая в реакцию с концентрированными щелочами:
- .
Применение
Основное применение вещества — протрава при крашении тканей.
Другие применения: как катализатор в химическом производстве; как коагулянт латекса; как реагент; как источник цинка в жидких удобрениях.
Безопасность
Вдыхание, проглатывание или контакт (кожа, глаза) с парами или самим веществом может привести к серьёзным травмам, ожогам или смерти.
При сильном нагреве выделяются раздражающие, едкие и токсичные газы. Не горюч, но усиливает горение других веществ. Многие реакции могут вызвать пожар или взрыв.
Примечания
Литература
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.