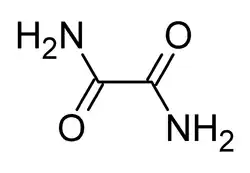
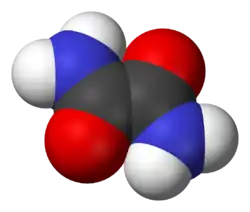
Оксамид
| Оксамид | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Оксамид | ||
| Традиционные названия | Оксамид, диамид щавелевой кислоты, | ||
| Хим. формула | |||
| Физические свойства | |||
| Состояние | бесцветные кристаллы | ||
| Молярная масса | 88,0654 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 122 °C | ||
| • кипения | 324 °C | ||
| • разложения | 350 °C | ||
| Классификация | |||
| Рег. номер CAS | 471-46-5 | ||
| PubChem | 10113 | ||
| Рег. номер EINECS | 207-442-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | RO4900000 | ||
| ChEBI | 48248 | ||
| ChemSpider | 9709 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Оксами́д (этандиами́д, диамид щаве́левой кислоты́) — органическое соединение с формулой .
При нормальных условиях — белое кристаллическое вещество. Растворимое в этаноле, мало растворимое в воде и нерастворимое в диэтиловом эфире.
Оксамид является диамидом щавелевой кислоты.
Синтез
Оксамид получают из синильной кислоты или цианидов путем их оксиления до дициана, например реакцией двухвалентной меди с цианидами. Полученный дициан далее гидролизуют[1].
В ходе данной реакции исходная степень окисления 2+ у меди изменяется до 1+:
- .
Также известен способ получения вещества через щавелевую кислоту, реакция происходит при нагреве, как побочный продукт возможно образование оксалата аммония:
- .
Химические свойства
При нагревании выше 350 °C в присутствии пентаоксида фосфора дегидратируется с образованием дициана[2]:
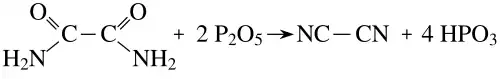 .
.
Применение
Основное применение оксамида — в качестве заменителя мочевины в азотных удобрениях. По сравнению с мочевиной оксамид гораздо медленнее гидролизуется с выделением аммиака, что способствует более полному усвоению азота растениями[3].
Оксамид используется в качестве стабилизатора при синтезе нитроцеллюлозы. Он также применяется в качестве высокоэффективного замедлителя скорости горения в твердотопливных ракетных двигателях, на основе перхлората аммония. Добавление оксамида в твёрдое топливо в концентрациях от 1 до 3 % по массе даёт замедление линейной скорости слоевого горения при минимальном снижении удельного импульса[4].
N, N'- замещённые оксамиды являются хорошими лигандами для катализируемого солями меди(I) аминирования и амидирования арилгалогенидов в реакции Ульмана-Гольдберга[5].
Производные оксамида образуют самоорганизующиеся монослои, связанные сеткой водородных связей[6].
Примечания
- ↑ Wilhelm Riemenschneider, Minoru Tanifuji. Oxalic Acid (англ.) // Ullmann's Encyclopedia of Industrial Chemistry / Wiley-VCH Verlag GmbH & Co. KGaA. — Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2000-06-15. — P. a18_247. — ISBN 978-3-527-30673-2. — doi:10.1002/14356007.a18_247. Архивировано 11 мая 2023 года.
- ↑ Williams H. E. The Chemistry of Cyanogen Compounds and Their manufacture and Estimation. — London: J. & A. Churchill, 1915. — С. 5. — 459 с. Архивировано 11 мая 2023 года.
- ↑ Ying Tang, Xun Li, Wenzhong Shen, Zengqiang Duan. Effect of the Slow-Release Nitrogen Fertilizer Oxamide on Ammonia Volatilization and Nitrogen Use Efficiency in Paddy Soil (англ.) // Agronomy. — 2018-04. — Vol. 8, iss. 4. — P. 53. — ISSN 2073-4395. — doi:10.3390/agronomy8040053. Архивировано 11 мая 2023 года.
- ↑ Djalal Trache, Filippo Maggi, Ilaria Palmucci, Luigi T. DeLuca, Kamel Khimeche, Marco Fassina, Stefano Dossi, Giovanni Colombo. Effect of amide-based compounds on the combustion characteristics of composite solid rocket propellants (англ.) // Arabian Journal of Chemistry. — 2019-12-01. — Vol. 12, iss. 8. — P. 3639–3651. — ISSN 1878-5352. — doi:10.1016/j.arabjc.2015.11.016. Архивировано 11 мая 2023 года.
- ↑ Zhou, Wei (23 сентября 2015). CuI/Oxalic Diamide Catalyzed Coupling Reaction of (Hetero)Aryl Chlorides and Amines. Journal of the American Chemical Society. 137 (37): 11942–11945. doi:10.1021/jacs.5b08411. ISSN 0002-7863. PMID 26352639.
- ↑ Nguyen T.L., Fowler F.W., Lauher J.W., "Commensurate and incommensurate hydrogen bonds.