Оксид рубидия
| Оксид рубидия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Оксид рубидия |
| Традиционные названия | Окись рубидия |
| Хим. формула | Rb2O |
| Рац. формула | Rb2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 186,94 г/моль |
| Плотность | 3,72 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 505 °C |
| Мол. теплоёмк. | 77,57 Дж/(моль·К) |
| Энтальпия | |
| • образования | 279,1 кДж/моль |
| Классификация | |
| Рег. номер CAS | 18088-11-4 |
| PubChem | 10154361 |
| Рег. номер EINECS | 241-993-2 |
| SMILES | |
| InChI | |
| ChemSpider | 8329869 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид рубидия — бинарное неорганическое соединение металла рубидия с кислородом, имеющее формулу Rb2O и относящееся к классу основных оксидов. Образует желтовато-белые кристаллы.
Получение
- Медленным взаимодействием металлического рубидия с кислородом на холоде:
- Разложением гидроксида рубидия:
- Разложением пероксида рубидия:
- Разложением в вакууме карбоната рубидия:
Физические свойства
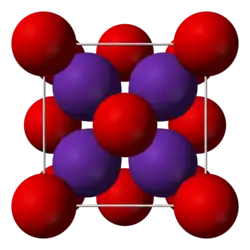
Оксид рубидия представляет собой светло-жёлтые кристаллы кубической сингонии, пространственная группа F m3m, параметры ячейки a = 0,6756 нм, Z = 4, структура типа CaF2.
При нагревании выше 150°С кристаллы переходят в кубическую фазу и становятся жёлто-оранжевыми. Чувствительны к свету, на нём темнеют и разлагаются. В сухом чистом воздухе вещество устойчиво[1].
Химические свойства
- При нагревании разлагается:
- Эта реакция идёт без нагревания под действием света.
- Взаимодействует с водой:
- Взаимодействует с кислотными оксидами с образованием средних и кислых солей. К примеру, уже при комнатной температуре поглощает из влажного воздуха углекислый газ:
Применение
- Катализатор в органическом синтезе.
Примечания
- 1 2 Лидин, 2000, с. 41.
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.