Паратолуолсульфоновая кислота
| Паратолуолсульфоновая кислота | |
|---|---|
 | |
| Общие | |
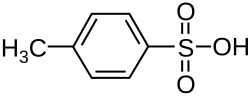
| Хим. формула | C7H8O3S |
| Классификация | |
| Рег. номер CAS | 104-15-4 |
| PubChem | 6101 и 20307553 |
| Рег. номер EINECS | 203-180-0 |
| SMILES | |
| InChI | |
| ChEBI | 27849 |
| ChemSpider | 5876 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
4-Толуолсульфоновая кислота (пара-Толуолсульфоновая кислота (ПТСК) или pTsOH) или тозиловая кислота (TsOH) — органическое соединение с химической формулой . Представляет собой белое твёрдое вещество, растворимое в воде, спиртах и других полярных органических растворителях.[1]
Группа известна как тозильная группа и часто обозначается аббревиатурой Ts или Tos.[1]
Как и другие сульфоновые кислоты, паратолуолсульфоновая кислота - сильная органическая кислота. Она примерно в миллион раз сильнее бензойной кислоты.[1]
Получение
TsOH получают в промышленных масштабах сульфированием толуола. Толуол гигроскопичен и легко гидратируется. Моногидрат толуолсульфокислоты содержит кристаллическую воду, а также воду в качестве примеси.
Для оценки общего содержания влаги в виде примесей используется метод Карла Фишера. Примеси могут быть удалены перекристаллизацией из концентрированного водного раствора с последующей азеотропной сушкой с толуолом.[2]
Химические свойства
- Толуолсульфокислоту можно превратить в п-толуолсульфоновый ангидрид путём нагревания с пентоксидом фосфора.[3]
- При нагревании с кислотой и водой толуолсульфокислота подвергается гидролизу до толуола:
Эта реакция является общей для арилсульфоновых кислот.[4][5]
Тозилаты
Алкилтозилаты являются алкилирующими агентами, потому что тозилат электроноакцепторная группа, а также является хорошо уходящей группой. Тозилат - это псевдогалогенид. Сложные эфиры толуолсульфоновой кислоты подвергаются нуклеофильной атаке или элиминированию. Восстановление эфиров тозилата даёт углеводород.
Таким образом, тозилирование с последующим восстановлением позволяет деоксигенировать спирты.[6]
Тозилаты также являются защитной группой для спиртов. Их получают реакцией спирта с 4-толуолсульфонилхлоридом, обычно в апротонном растворителе, часто в пиридине.[7]
Применение
Тозиловая кислота находит применение в органическом синтезе в качестве «растворимого в органике» кислотного катализатора. Примеры использования включают:
Смотрите также
Примечания
- 1 2 3 Baghernejad, Bita (2011-08-31). Application of p-toluenesulfonic Acid (PTSA) in Organic Synthesis. Current Organic Chemistry. 15 (17): 3091–3097. doi:10.2174/138527211798357074.
- ↑ Armarego, W. L. F. Purification of Laboratory Chemicals.. — 8th. — Oxford : Elsevier Science, 2003. — P. 612. — ISBN 978-0-12-805457-4.
- ↑ L. Field; J. W. McFarland (1963), p-Toluenesulfonic Anhydride, Org. Synth.; Coll. Vol., 4: 940
{{citation}}:|title=пропущен или пуст (справка) - ↑ C. M. Suter. The Organic Chemistry of Sulfur. — 1944. — P. 387–388.
- ↑ J. M. Crafts (1901). Catalysis in concentrated solutions. J. Am. Chem. Soc. 23 (4): 236–249. doi:10.1021/ja02030a007. Архивировано 21 июня 2022. Дата обращения: 21 июня 2022.
- ↑ Winstein, S. (1 августа 1955). 7-Norbornenyl and 7-Norbornyl cations. Journal of the American Chemical Society. 77 (15): 4183–4184. doi:10.1021/ja01620a078. ISSN 0002-7863.
- ↑ Nucleophilic Substitution. Дата обращения: 21 июня 2022. Архивировано 15 июня 2021 года.
- ↑ H. Griesser, H.; Öhrlein, R.; Schwab, W.; Ehrler, R.; Jäger, V. (2004), 3-Nitropropanal, 3-Nitropropanol, and 3-Nitropropanal Dimethyl Acetal, Org. Synth.; Coll. Vol., 10: 577
{{citation}}:|title=пропущен или пуст (справка) - ↑ Furuta, K.; Gao, Q.-z.; Yamamoto, H. (1998), Chiral (Acyloxy)borane Complex-catalyzed Asymmetric Diels-Alder Reaction: (1R)-1,3,4-Trimethyl-3-cyclohexene-1-carboxaldehyde, Org. Synth.; Coll. Vol., 9: 722
{{citation}}:|title=пропущен или пуст (справка) - ↑ Imwinkelried, R.; Schiess, M.; Seebach, D. (1993), Diisopropyl (2S,3S)-2,3-O-isopropylidenetartrate, Org. Synth.; Coll. Vol., 8: 201
{{citation}}:|title=пропущен или пуст (справка)