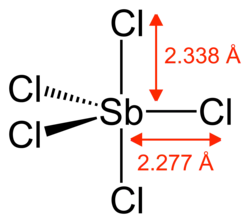
Хлорид сурьмы(V)
| Хлорид сурьмы(V) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Пентахлорид сурьмы |
| Традиционные названия | хлористая сурьма |
| Хим. формула | SbCl5 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 299,02 г/моль |
| Плотность | 2,336; 2,346 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2,8; 3,2; 4,0 °C |
| • кипения |
681,86 кПа разл. 140 °C |
| Энтальпия | |
| • образования | -450,8 кДж/моль |
| Оптические свойства | |
| Показатель преломления | 1,59255 |
| Классификация | |
| Рег. номер CAS | 7647-18-9 |
| PubChem | 24294 и 90479165 |
| Рег. номер EINECS | 231-601-8 |
| SMILES | |
| InChI | |
| RTECS | CC5075000 |
| ChemSpider | 10613049 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид сурьмы(V) — бинарное неорганическое соединение сурьмы и хлора с формулой SbCl5, бесцветная жидкость (иногда окрашена в светло-жёлтые тона из-за примеси хлора), сильно дымит на воздухе, активно реагирует с водой.
Получение
Физические свойства
Хлорид сурьмы(V) — бесцветная гигроскопичная жидкость, «дымит» во влажном воздухе, разлагается водой. В вакууме перегоняется без разложения.
Растворяется в жидком хлористом водороде, хлороформе, этаноле, метаноле, амиловом спирте, тетрахлориде углерода.
В растворе в хлороформе при добавлении воды образует кристаллогидраты SbCl5•H2O и SbCl5•4H2O.
Химические свойства
- Разлагается при нагревании
- Реагирует с холодной водой:
- и с горячей:
- Реагирует с щелочами:
- С соляной кислотой образует гексахлоростибат водорода:
- С хлоридами щелочных металлов и нитрозилхлоридом (в неполярном растворителе, например, CCl4) образует комплексные соли гексахлоростибаты:
- Реагирует с металлической сурьмой:
Применение
- Хлорирующий агент.
- Для получения сурьмы высокой чистоты.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Химические свойства неорганических веществ: Учеб. пособие для вузов — 3-е изд., испр — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
