Пентахлорфенол
| Пентахлорфенол[1][2] | |
|---|---|
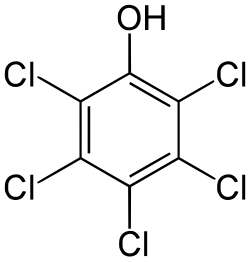 | |
| Общие | |
| Хим. формула | C6Cl5OH |
| Физические свойства | |
| Молярная масса | 266,34 г/моль |
| Плотность | 1,978 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 188–191 °C |
| • кипения | 310 °C |
| • разложения | 588 ± 1 ℉[3] |
| Давление пара | 0,0001 ± 0,0001 мм рт.ст.[3] |
| Классификация | |
| Рег. номер CAS | 87-86-5 |
| PubChem | 992 |
| Рег. номер EINECS | 201-778-6 |
| SMILES | |
| InChI | |
| RTECS | SM6300000 |
| ChEBI | 17642 |
| ChemSpider | 967 |
| Безопасность | |
| Краткие характер. опасности (H) |
H301+H311, H315, H319, H330, H335, H351, H410 |
| Меры предостор. (P) |
P201, P273, P280, P301+P310+P330, P302+P352+P312, P304+P340+P310 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пентахлорфенол — органическое вещество, принадлежащее к классу фенолов. Применяется как реагент для образования активированных эфиров в синтезе пептидов[1].
Получение и обращение
Пентахлорфенол является коммерчески доступным веществом. Для очистки его перекристаллизовывают из этанола (в виде моноклинных призм) или бензола (игольчатые кристаллы) и сушат в вакууме. Пентахлорфенол является весьма токсичным; потенциальный тератоген. Вдыхание, проглатывание и всасывание через кожу может иметь летальные последствия. Хранить его необходимо в прохладном, сухом месте[1].
Строение и физические свойства
Пентахлорфенол растворим в диэтиловом эфире, этаноле, горячем бензоле, лигроине; нерастворим в воде[1].
Применение
Основной сферой применения пентахлорфенола является синтез пептидов, где он выступает в качестве реагента для активации карбоксильной группы и, как следствие, облегчения образования амидной связи между карбоновыми кислотами и аминами. Впервые об использовании пентахлорфениловых эфиров было сообщено в 1965 году, хотя краткие сообщения появлялись и до этого[1].
Преимуществом пентахлорфенильной активирующей группы является то, что она хорошо совместима с бензилоксикарбонильной группой и трет-бутильной группой. Кроме того, пентахлорфениловые эфиры аминокислот и пептидов легче очищать, поскольку они в целом имеют более высокие температуры плавления, по сравнению с другими активированными эфирами[1].
| Активированный эфир | Х = OC6Cl5 | Х = OC6Н2Cl3 | Х = OC6H4NO2 |
|---|---|---|---|
| Cbz-Ala-X | 172–173 | 104 | 78 |
| Cbz-Val-X | 144 | 94 | 66 |
| Cbz-Gly-X | 185 | 107–108 | 128 |
| Cbz-Phe-X | 158 | 142 | 126 |
Пентахлорфениловые эфиры также являются одними из самых реакционноспособных. Так, обработка пентахлорфенилового Сbz-L-фенилаланина бензиламином в диоксане даёт время его полужизни, равное 1,34 мин, тогда как трихлорфениловый и п-нитрофениловый эфир в тех же условиях живут гораздо дольше (4,9 и 23,2 мин соответственно)[1].
Первым описанным примером использования пентахлорфенилового эфира для синтеза полипептидов является синтез поли-β-L-аспартамовой кислоты, которую необходимо было синтезировать в оптически чистой форме для различных химических, биологических и иммунохимических исследований. С этой целью аминокислоту активировали пентахлорфенолом в присутствии дициклогексилкарбодиимида, и полученный активированный эфир быстро полимеризовался в присутствии третичного амина, давая полиаминокислоту с более высокой молекулярной массой, чем этого удавалось достичь при использовании п-нитрофенилового производного[1].
Примечания
- 1 2 3 4 5 6 7 8 9 EROS, 2001.
- ↑ Pentachlorophenol (англ.). Sigma-Aldrich. Дата обращения: 5 января 2021. Архивировано 7 декабря 2015 года.
- 1 2 http://www.cdc.gov/niosh/npg/npgd0484.html
Литература
- Dobbs A. P. Pentachlorophenol (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2001. — doi:10.1002/047084289x.rp023.
Ссылки
- ИК-спектр пентахлорфенола. Sigma-Aldrich. Дата обращения: 29 июля 2019. Архивировано 27 сентября 2020 года.