Перманганат кальция
| Перманганат кальция | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Перманганат кальция |
| Традиционные названия | Марганцовокислый кальций |
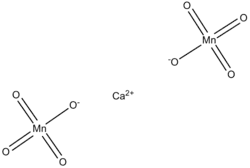
| Хим. формула | Ca(MnO4)2 |
| Физические свойства | |
| Состояние | гидрат - пурпурные кристаллы |
| Молярная масса | 277,95 г/моль |
| Плотность | гидрат - 2,4 г/см³ |
| Химические свойства | |
| Растворимость | |
| • в воде | гидрат - 33114; 33825; |
| Классификация | |
| Рег. номер CAS | 10118-76-0 |
| PubChem | 24959 |
| Рег. номер EINECS | 233-322-7 |
| SMILES | |
| InChI | |
| RTECS | EW3860000 |
| ChemSpider | 23333 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Перманганат кальция — неорганическое соединение, соль кальция и марганцовой кислоты с формулой Ca(MnO4)2, хорошо растворяется в воде, образует кристаллогидраты — пурпурные кристаллы.
Получение
- Реакция оксида кальция и оксида марганца:
- Электролиз растворов манганатов щелочных металлов и хлорида кальция.
Физические свойства
Перманганат кальция образует кристаллы.
Хорошо растворяется в воде.
Образует кристаллогидрат состава Ca(MnO4)2•4H2O, ромбическая сингония, пространственная группа P ccn, параметры ячейки a = 1,39791 нм, b = 0,55404 нм, c = 1,33908 нм, Z = 4 [1] .
Применение
Окислитель и дезинфицирующее средство, используется при крашении, в органическом синтезе, для очистки воды, для отбеливания бумажной массы и как окислитель перекиси водорода в ЖРД.
Примечания
- ↑ Reinhard Nesper, et al. Crystal structure of calciumpermanganate tetrahydrate, Ca(MnO4)2·4H2O, CaH8Mn2O12 // Zeitschrift für Kristallographie. — 2012. — Т. 227, № 4. — doi:10.1524/ncrs.2012.0250.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.