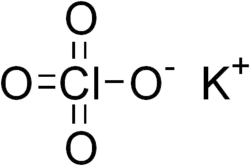
Перхлорат калия
| Перхлорат калия | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Перхлорат калия | ||
| Сокращения | ПХК | ||
| Традиционные названия | Хлорная соль, хлорный калий | ||
| Хим. формула | KClO4 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 138,55 г/моль | ||
| Плотность | 2,52 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 525 °C | ||
| • кипения | с разложением °C | ||
| • разложения | 630 °C | ||
| Фазовые переходы | 299,5 °C | ||
| Энтальпия | |||
| • образования | -433 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в | 4,9г при 50°C | ||
| • в | 18,2г при 100°C | ||
| Классификация | |||
| Рег. номер CAS | 7778-74-7 | ||
| PubChem | 516900 и 24505 | ||
| Рег. номер EINECS | 231-912-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | SC9700000 | ||
| Номер ООН | 1489 | ||
| ChemSpider | 22913 и 21241917 | ||
| Безопасность | |||
| Токсичность | слаботоксичен, сильный оксилитель | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Перхлора́т ка́лия, хлорноки́слый ка́лий — химическое соединение, калиевая соль хлорной кислоты с формулой KClO4, очень сильный окислитель. Часто используется аббревиатура ПХК.
Общие сведения
Бесцветное кристаллическое вещество, кристаллы имеют ромбическую (β-) форму. При 299,5 °C происходит переход в кубическую (α-) форму. Температура плавления 610 °C. Молекулярная масса 138,55 а. е. м.Плохо растворим в воде - 2,03 г на 100 г воды при 25 градусах Цельсия. Негигроскопичен, в отличие от почти всех перхлоратов.
Химические свойства
- Перхлорат калия как окислитель может взаимодействовать с широким кругом горючих веществ, например, с глюкозой:
- Разлагается при нагревании до хлорида калия при участии катализатора MnO2:
- Образует хлорную кислоту при нагревании в вакууме с концентрированной серной кислотой[1]:
Получение
Обменная реакция перхлората натрия с хлоридом калия:
Электролиз или осторожное нагревание хлората калия:
Применение
Основные способы применения перхлората калия связаны с его окисляющими свойствами:
- в фейерверках
- в твёрдых ракетных топливах
- в составе взрывчатых веществ — перхлоратитов
- в воспламенителях
- в хлопушках
- в петардах
В современных твёрдых ракетных топливах и взрывчатых веществах практически не используется, взамен него применяют перхлорат аммония. В медицине перхлорат калия используется как средство от токсического зоба и как радиопротектор, выпускается в виде таблеток по 0,25 грамма.
Калориметрия
Перхлорат калия используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Примечания
- ↑ Лидин, 2000, с. 262.
Ссылки
- MSDS (англ.)
- Источник: Иванов В.М., Семененко К.А., Прохорова Г.В., Симонов Е.Ф. Аналитическая химия натрия. -М.: Наука, 1986. C. 19.
- Кнунянц И. Л. Химический Энциклопедический словарь. -М.: Советская энциклопедия 1983. С. 234.
Литература
Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.