Перхлорат кальция
| Перхлорат кальция | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Перхлорат кальция |
| Традиционные названия | Хлорнокислый кальций |
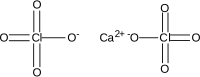
| Хим. формула | Ca(ClO4)2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 238,98 г/моль |
| Плотность | 2,651 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 270 °C |
| Энтальпия | |
| • образования | -744 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 188,625 г/100 мл |
| • в этаноле | 166,225 г/100 мл |
| • в метаноле | 237,425 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13477-36-6, 15627-86-8 |
| PubChem | 61629 |
| Рег. номер EINECS | 236-768-0 |
| SMILES | |
| InChI | |
| ChemSpider | 55537 |
| Безопасность | |
| Краткие характер. опасности (H) |
H271 |
| Меры предостор. (P) |
P220 |
| Сигнальное слово | опасно |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Перхлорат кальция — неорганическое соединение, соль кальция и хлорной кислоты с формулой Ca(ClO4)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Физические свойства
Перхлорат кальция образует бесцветные кристаллы.
Хорошо растворяется в воде, этаноле, метаноле, ацетоне. Слабо растворяется в диэтиловом эфире.
Образует кристаллогидрат состава Ca(ClO4)2•4H2O, триклинная сингония, пространственная группа P 1, параметры ячейки a = 0,5578 нм, b = 0,7813 нм, c = 1,1761 нм, α = 100,740°, β = 89,658°, γ = 91,069° [1].
Примечания
- ↑ Joanna Hetman´czyk, Anna Migdał-Mikuli, Edward Mikuli, Krystyna Hołderna-Natkaniec, Łukasz Hetman´czyk, Ireneusz Natkaniec. Phase transitions and H2O motions in [Ca(H2O)4(ClO4)2 studied by infrared spectroscopy, inelastic/quasielastic incoherent neutron scattering and proton magnetic resonance. Part II] // Journal of Molecular Structure. — 2009. — Т. 923. — С. 103–109.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.
