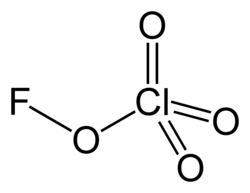
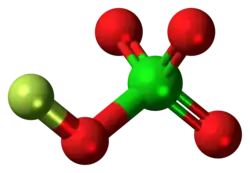
Перхлорат фтора
| Перхлорат фтора | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | ClO4F | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -167,3 °C | ||
| • кипения | -16 °C | ||
| Энтальпия | |||
| • образования | 37,656 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | 10049-03-3 | ||
| PubChem | 13022374 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 10326178 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Перхлора́т фто́ра — редко встречающееся химическое соединение фтора, хлора и кислорода с химической формулой (или ). Это крайне нестабильный взрывоопасный газ[1] с резким запахом[2].
Получение
В одном из синтезов используются фтор и хлорная кислота[3]:
Другой метод синтеза включает в себя термическое разложение перхлората тетрафтораммония[4]:
Структура
Перхлорат фтора не может выступать в качестве аналога хлорной кислоты, поскольку атом фтора более электроотрицателен, чем атом кислорода. Вещество содержит атом кислорода в степени окисления 0 из-за его электроотрицательности, которая выше, чем у хлора, но ниже, чем у фтора.
Химические свойства
Является сильным окислителем и реагирует с иодид-ионом:
Перхлорат фтора также может реагировать с тетрафторэтиленом[5] в реакции радикального присоединения[6]:
Безопасность
Перхлорат фтора является нестабильным взрывоопасным веществом. Небольшие количества восстановителей могут вызвать его детонацию. Продуктами таких реакций разложения могут быть галогениды кислорода, интергалогениды и другие опасные вещества.
Примечания
- ↑ Pradyot Patnaik. A comprehensive guide to the hazardous properties of chemical substances, 3rd ed., Wiley-Interscience, 2007. ISBN 0-471-71458-5
- ↑ Robert Alan Lewis. Lewis' dictionary of toxicology, CRC Press, 1998, p. 508. ISBN 1-56670-223-2
- ↑ Rohrback, G. H.; Cady, G. H. (1947). The Preparation of Fluorine Perchlorate from Fluorine and Perchloric Acid. Journal of the American Chemical Society. 69 (3): 677–678. doi:10.1021/ja01195a063.
- ↑ Schack, C. J.; Christe, K. O. (1979). Reactions of fluorine perchlorate with fluorocarbons and the polarity of the oxygen-fluorine bond in covalent hypofluorites. Inorganic Chemistry. 18 (9): 2619–2620. doi:10.1021/ic50199a056.
- ↑ Greenwood N. N., Earnshaw A. Chemistry of the Elements (англ.). — 2nd Ed. — Oxford: Elsevier; Butterworth-Heinemann, 2012. — 1600 p. — ISBN 0-08-037941-9.
- ↑ Schack, Carl J.; Christe, Karl O. (1979). Reactions of fluorine perchlorate with fluorocarbons and the polarity of the oxygen-fluorine bond in covalent hypofluorites. Inorganic Chemistry. 18 (9): 2619. doi:10.1021/ic50199a056.