Соль Мора
| Соль Мора | |
|---|---|
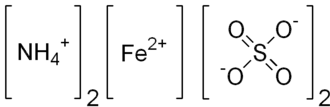 | |
| | |
| Общие | |
| Систематическое наименование |
Сульфат аммония-железа(II) |
| Традиционные названия | Соль Мора |
| Хим. формула | FeSO4·(NH4)2SO4·6H2O |
| Физические свойства | |
| Молярная масса | 392,1406 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 21,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10045-89-3 |
| PubChem | 71312611, 24863 и 57495516 |
| Рег. номер EINECS | 233-151-8 |
| SMILES | |
| InChI | |
| ChEBI | 76243 |
| ChemSpider | 23246 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т аммо́ния-желе́за(II) (соль Мо́ра) — неорганическое соединение, двойная сернокислая соль железа и аммония с формулой Fe(NH4)2(SO4)2[1].
Нахождение в природе

В природе сульфат аммония-железа встречается в виде редкого минерала морита[2].
Физические свойства
Химическая формула: FeSO4·(NH4)2SO4·6H2O (или Fe(NH4)2(SO4)2·6H2O). Представляет собой неярко сине-зелёные моноклинные кристаллы. Растворяется в воде. Растворимость соли Мора в воде равна 21,6 г безводного вещества в 100 г воды при 20 °C. В кислоте растворимость несколько больше. Устойчива на воздухе. Парамагнетик. Соль Мора используется в медицине (добавляется в пищу, или в виде фармакопейного препарата, при нехватке в организме больного железа), для определения уробилина, в фармацевтике.
Получение
В лаборатории получают выпариванием раствора свежеприготовленного сульфата железа (+2) , к которому был прилит насыщенный горячий раствор сульфата аммония .[3]
Применение
Соль Мора применяется в научно-исследовательских работах и химических лабораториях как удобная форма препарата железа(II): для определения концентрации (титра) перманганата калия в растворах, при определении концентраций хрома и ванадия в растворах этилового спирта и эфира. В растворах ион Fe2+ даже слабыми окислителями легко окисляется до Fe3+.
Также, в виде концентрированных растворов, применяется для пропитки древесины для защиты её от гниения. Имеет и другие применения.
Соль названа в честь немецкого химика Карла Фридриха Мора (1809—1879).
См. также
Примечания
- ↑ Андрей Дроздов, Вадим Ерёмин, Николай Кузьменко, Валерий Лунин. Химия. Углублённый уровень. 11 класс. — 2020.
- ↑ Морит. Минерал Морит. Описание, свойства, месторождения, фотографии. Mohrite. Минералы и месторождения. webmineral.ru. webmineral.ru. Дата обращения: 31 мая 2025.
- ↑ Е.И. Ардашникова, Е.Д. Демидова, В.А. Алёшин. Неорганическая химия. Практикум / А.В. Шевельков. — "Лаборатория знаний", 2021. — С. 311. — 473 с. — ISBN 978-5-00101-031-9.
