Теллуриты
| Теллуриты | |
|---|---|
 | |
| Общие | |
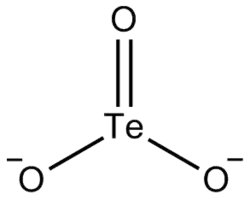
| Хим. формула | O3Te²⁻ |
| Физические свойства | |
| Молярная масса | 175,6 + ... г/моль |
| Классификация | |
| Рег. номер CAS | 15852-22-9 |
| PubChem | 115037 |
| SMILES | |
| InChI | |
| ChEBI | 30477 |
| ChemSpider | 102958 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Теллу́риты — группа химических соединений, соли теллуристой кислоты H2TeO3. Теллуритом также называется анион TeO32−.
Получение и свойства
Стандартный метод синтеза теллуритов щелочных и щёлочноземельных металлов - нагревание диоксида теллура с карбонатами целочных металлов или оксидами щёлочноземельных металлов:
Теллуриты щелочных металлов растворимы в воде, переходных - нерастворимы и могут быть получены реакцией обмена:
Некоторые теллуриты в таких условиях высаждаются в виде кристаллогидратов - в частности и .
Теллуриты щелочных металлов при сплавлении с диоксидом теллура образуют пиротеллуриты:
Теллуриты окисляются до теллуратов под действием разнообразных окислителей и в разнообразных условиях: при сплавлении с нитратами и хлоратами щелочных металлов, хромовой кислотой и хроматами или бихроматами в кислых условиях, перманганатими и галогенами.
Окисление теллурата серебра бромом в воде ведёт к образованию раствора ортотеллуровой кислоты:
Биологическая роль
(TeO₃²⁻) — высокотоксичный анион теллура с заметной биологической активностью, особенно из-за его токсического воздействия на различные организмы, включая бактерии, растения и людей. Все теллуриты – яды[1].
Применение
Широкого применения теллуриты не нашли. Теллуриты щелочных металлов используются в бактериологии. Кроме того, теллурит калия используют в качестве добавок при приготовлении питательных сред для выделения возбудителей дифтерии, холеры и других бактерий. А теллурит натрия используется для повышения коррозионной стойкости гальванического никеля[1].
См. также
Примечания
- 1 2 Tellurium Derivative - an overview | ScienceDirect Topics. www.sciencedirect.com. Дата обращения: 25 апреля 2025.
Литература
- Satya, Prakash. Advanced Chemistry of Rare Elements. — S. Chand Publishing, 2013. — P. 313-314. — ISBN 978-81-219-4254-6.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.