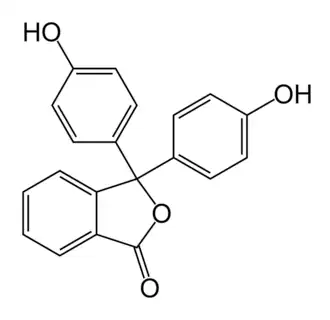
Фенолфталеин
| Фенолфталеин | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
4,4'-диоксифталофенон |
| Традиционные названия | Фенолфталеин, пурген |
| Хим. формула | C20H14O4 |
| Физические свойства | |
| Молярная масса | 318,31 г/моль |
| Плотность | 1,3 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 277—279 °C [1] |
| • кипения | 557,8 °C[2] |
| Классификация | |
| Рег. номер CAS | 77-09-8 |
| PubChem | 4764 |
| Рег. номер EINECS | 201-004-7 |
| SMILES | |
| InChI | |
| ChEBI | 34914 |
| ChemSpider | 4600 |
| Безопасность | |
| Краткие характер. опасности (H) |
H315, H350, H341, H361 |
| Меры предостор. (P) |
P201, P281, P308+P313 |
| Сигнальное слово | ОПАСНО! |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Фенолфталеин | |
|---|---|
| (pH индикатор) | |
| Нижний предел | Верхний предел |
| pH 0 | pH 8,2 |
| orange | no |
| Фенолфталеин | |
|---|---|
| (pH индикатор) | |
| Нижний предел | Верхний предел |
| pH 8.2 | pH 11 |
| no | magenta |
| Фенолфталеин | |
|---|---|
| (pH индикатор) | |
| Нижний предел | Верхний предел |
| pH 11 | pH 12 |
| magenta | no |
Фенолфталеи́н (4,4'-диоксифталофенон или 3,3-бис-(4-гидроксифенил)фталид) — трифенилметановый краситель, кислотно-основный индикатор, изменяющий окраску от бесцветной (при pH < 8,2) до красно-фиолетовой, «малиновой» (в щелочной). При рН>12 индикатор опять обесцвечивается.
Вещество представляет собой бесцветные или слегка желтоватые ромбовидные кристаллы, плохо растворимые в воде, но хорошо — в спирте и диэтиловом эфире. Фенолфталеин без заметного вкуса, но имеет специфический запах.
Синтез
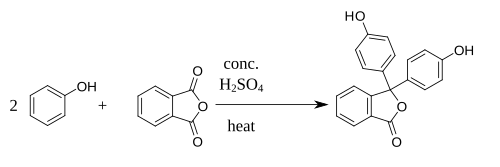
Синтезируется путём конденсации фенола и фталевого ангидрида при 105—110 °C в присутствии ZnCl2 или концентрированной серной кислоты.
 |
Химические свойства
При сплавлении фенолфталеина с NaOH образуется 4,4'-дигидроксибензофенон, при нагревании с конц. H2SO4 — фенол и 2-гидроксиантрахинон.
Применение
В качестве индикатора
Фенолфталеин меняет окраску в зависимости от уровня pH среды[3]. Он способен существовать в нескольких формах, которые превращаются одна в другую при изменении кислотности.
| Форма | H2In | In | In2− | In(OH)3− |
|---|---|---|---|---|
| Структура | 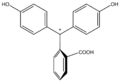 | 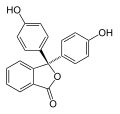 | 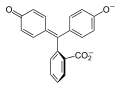 | 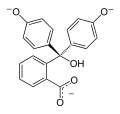 |
| pH | <-1 | 0-7 | 8-10 | 12-14 |
| Реакция среды | сильнокислая | слабокислая и нейтральная | щелочная | сильнощелочная |
| Цвет | Оранжевый | Розовый или фуксиновый | Бесцветный | |
| Модель | 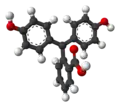 | 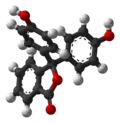 | 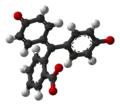 | 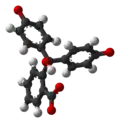 |
| Изображение |  |  |
Применяется в аналитической химии при титровании водных растворов (используют раствор в этаноле).
Применение в медицине
До обнаружения определённых проканцерогенных свойств фенолфталеин более полутора веков использовался в медицине как слабительное средство (пурген), хотя обладает кумулятивными свойствами и может оказывать раздражающее действие на почки и сердце
Мнемонические правила
Для запоминания цвета фенолфталеина в щелочной среде (в случае его применения в качестве индикатора) существуют мнемонические правила:
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Попасть в кислоту для других — неудача,
Но он перетерпит без вздохов, без плача.
Зато в щелочах у фенолфталеина
Настанет не жизнь, а сплошная малина!
Ярче цвета всех малин наш фенолфталеин!
См. также
Литература
- Бейтс Р., Определение рН. Теория и практика, пер. с англ., 2 изд., Л., 1972, с. 126.
- Химическая энциклопедия; в 5 т.; т.5 Три-Ятр; под ред. Зефиров Н.С; М.: Большая Российская энциклопедия, 1998.-783с; ил.
Примечания
- ↑ Фенолфталеин // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. [74] (стб. 139-140). — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ https://www.chemenu.com/products/CM157263
- ↑ В таблице приведены примерные границы существования структурных модификаций. Точные границы перехода цвета приведены в инфобоксах справа.
