Фенолят натрия
| Фенолят натрия | |
|---|---|
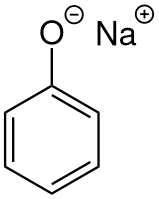 | |
| Общие | |
| Систематическое наименование |
Фенолят натрия |
| Хим. формула | C6H5ONa |
| Физические свойства | |
| Состояние | Твёрдое |
| Молярная масса | 116,09 г/моль |
| Классификация | |
| Рег. номер CAS | 139-02-6 |
| PubChem | 4445035 |
| Рег. номер EINECS | 205-347-3 |
| SMILES | |
| InChI | |
| ChEBI | 52476 |
| ChemSpider | 8420 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Феноля́т на́трия (химическая формула — C6H5ONa) — органическая натриевая соль фенола.
При стандартных условиях, фенолят натрия — это кристаллическое вещество белого цвета.
Структура
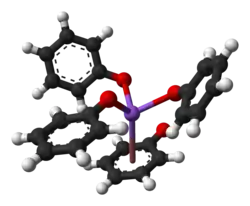
Как и другие алкоголяты натрия, твёрдый фенолят натрия имеет сложную структуру, включающую несколько связей Na-O. Не растворённый фенолят является полимером, в котором каждый Na-центр связан с тремя кислородными лигандами, а также с фенильным кольцом. Аддукты фенолята натрия являются молекулярными соединениями, например [NaOPh]4(ГФМТА)4.[1]
Фенолят натрия можно получить путём «щелочного сплавления» бензолсульфоновой кислоты, в результате чего SO3-группа замещается OH-группой:
Ранее этот способ получения был основным промышленным путём получения фенола.
Химические свойства
Алкилирование даёт фенильные эфиры:[2]
С помощью ацилирующих агентов можно получить сложные эфиры:
Фенолят натрия подвержен определённым типам реакций электрофильного замещения. Например, он реагирует с диоксидом углерода с образованием 2-гидроксибензоата, сопряжённого основания салициловой кислоты. Однако, в целом, электрофилы необратимо атакуют кислородный центр в феноляте.
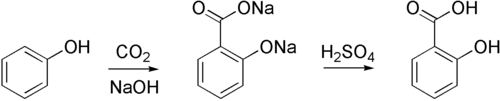
Получение
Чаще всего раствор фенолята натрия получают обработкой фенола гидроксидом натрия.[2] Безводный фенолят натрия можно получить путём реакции фенола с натрием. Современным способом получения является реакция метоксида натрия с фенолом:[3]
Применение
Фенолят натрия используется для синтеза многих, производных от него, органических веществ, таких как ариловые эфиры.
Примечание
- ↑ Michael Kunert, Eckhard Dinjus, Maria Nauck, Joachim Sieler «Structure and Reactivity of Sodium Phenoxide — Following the Course of the Kolbe-Schmitt Reaction» Chemische Berichte 1997 Volume 130, Issue 10, pages 1461—1465. doi:10.1002/cber.19971301017
- 1 2 C. S. Marvel, A. L. Tanenbaum (1929). γ-Phenoxypropyl Bromide. Org. Synth. 9: 72. doi:10.15227/orgsyn.009.0072.
- ↑ Kornblum, Nathan (1959). Heterogeneity as a Factor in the Alkylation of Ambident Anions: Phenoxide Ions1,2. Journal of the American Chemical Society. 81 (11): 2705–2715. doi:10.1021/ja01520a030.