Феррат бария
| Феррат бария | |
|---|---|
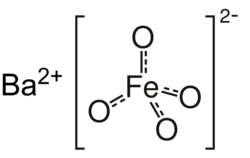 | |
 | |
| Общие | |
| Хим. формула | BaFeO4 |
| Внешний вид | Порошок бурого цвета |
| Физические свойства | |
| Состояние | Твёрдое |
| Молярная масса | 257,16 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | Нерасстворим |
| Классификация | |
| Рег. номер CAS | 13773-23-4 |
| SMILES | |
| InChI | |
| ChemSpider | 57448624 |
| Безопасность | |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Феррат бария — это неорганическое химическое соединение. Является бариевой солью железной кислоты.
Физические свойства
Соль представляет собой нерасстворимый порошок бурого цвета.
Феррат бария обладает парамагнитными свойствами из-за двух неспаренных электронов и имеет тетраэдрическую молекулярную геометрию[1].
Структура и физические характеристики
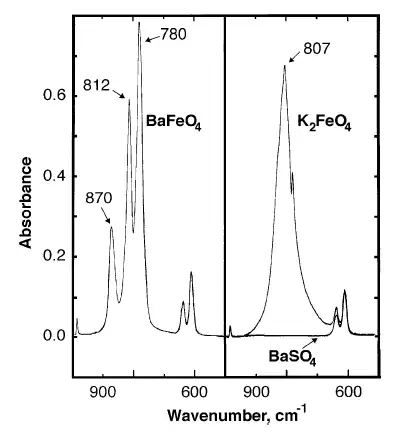
Пики поглащаемости инфракрасного спектра: 870, 812, 780 см-1.
BaFeO4 подчиняется закону Кюри-Вейсса и имеет магнитный момент (2,92 ± 0,03) * 10-23 А*м2 (3,45 ± 0,1 БМ) с константой Вейсса −89 К[2].
Его пространственная группа — Pnma, а параметры решетки составляют a = 0,8880 нм, b = 0,5512 нм и c = 0,7214 нм[3].
Химические свойства
Феррат бария является наиболее стабильным из соединений феррата(VI).
Разлагается при температуре ≈ 120 °C на оксид бария, оксид железа(ll) и кислород.
На практике образуется смесь оксидов железа(ll-lll).
Феррат бария может быть легко разложен всеми растворимыми кислотами, включая угольную кислоту.
Если диоксид углерода пропустить через воду, в которой суспендирован феррат бария, он полностью разложится с образованием карбоната бария, гидроксида железа(lll) и кислорода. Щелочные сульфаты разлагают феррат бария, который не был высушен, образуя сульфат бария, гидроксид железа(lll) и кислород[4][5].
Производство
Феррат бария в основном получают двумя способами. Сухой синтез обычно выполняется с использованием высоких температур, например, путем сплавления гидроксида бария и гидроксида железа(II) в присутствии кислорода до температуры около 800-900 °C[6].
Добавление растворимой соли бария к раствору феррата щелочного металла приводит к образованию темно-бордового осадка феррата бария. Это также качественная реакция на ферраты[7].
Феррат бария можно получить добавлением оксида бария к смеси гипохлорита натрия и нитрата железа при комнатной температуре. Чистоту продукта можно повысить, проводя реакцию при низкой температуре в отсутствие атмосферного диоксида углерода и быстро фильтруя и высушивая осадок, что снижает соосаждение гидроксида бария и карбоната бария в качестве примесей[8].
Применение
Все ферраты — очень сильные окислители (более сильные, чем перманганаты). Эти свойства применяются для органического синтеза[5].
Другие его применения включают удаление цвета, удаление роданинов и цианидов (реагирует с ними до безопасных комплексов, в частности гексацианоферрата бария), уничтожение бактерий и очистку загрязненных и сточных вод.
Соли феррата(VI) являются энергетическими катодными материалами в батареях «супер-железо». Катоды, содержащие соединения феррата(VI), называются катодами «супер-железо» из-за их высокоокисленной железной основы, множественного переноса электронов и высокой внутренней энергии. Среди всех солей феррата(VI), феррат бария поддерживает необычайно легкую передачу заряда, что важно в области высокой мощности щелочных батарей[9].
Примечания
- ↑ Арнольд Ф. Х. Нильс Виберг. Holleman-Wiberg's Inorganic Chemistry (нем.). — Elsevier Science, 2001. — S. 1457–1458. — 1924 S. — ISBN 9780123526519.
- ↑ R. J. Audette, J. W. Quail. Potassium, rubidium, cesium, and barium ferrates(VI). Preparations, infrared spectra, and magnetic susceptibilities (англ.) // Inorganic Chemistry. — 1972-08-01. — Vol. 11, iss. 8. — P. 1904–1908. — ISSN 0020-1669. — doi:10.1021/ic50114a034.
- ↑ Xiao-Min Ni, Ming-Rong Ji, Zhi-Ping Yang, Hua-Gui Zheng. Preparation and structure characterization of nanocrystalline BaFeO4 (англ.) // Journal of Crystal Growth. — 2004-01-15. — Vol. 261, iss. 1. — P. 82–86. — ISSN 0022-0248. — doi:10.1016/j.jcrysgro.2003.09.024.
- ↑ Khimia_Polny_spravochnik_dlya_podgotovki_k_EGE - Стр 7. StudFiles (23 февраля 2016). Дата обращения: 21 марта 2025.
- 1 2 Барий феррат - Справочник химика 21 ХИМИЯ И ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ. www.chem21.info. Дата обращения: 21 марта 2025.
- ↑ R. K. Sharma. Text Book of Coordination Chemistry (англ.). — Discovery Publishing House, 2007. — 334 p. — ISBN 978-81-8356-223-2.
- ↑ Gary Wulfsberg. Principles Of Descriptive Inorganic Chemistry (англ.). — University Science Books, 1991-05-29. — 494 p. — ISBN 978-0-935702-66-8.
- ↑ J. R. Gump, W. F. Wagner, J. M. schreyer. Preparation and Analysis of Barium Ferrate(VI) (англ.) // Analytical Chemistry. — 1954-12-01. — Vol. 26, iss. 12. — P. 1957–1957. — ISSN 0003-2700. — doi:10.1021/ac60096a027.
- ↑ Stuart Licht, Vera Naschitz, Baohui Wang. Rapid chemical synthesis of the barium ferrate super-iron Fe (VI) compound, BaFeO4 (англ.) // Journal of Power Sources. — 2002-06-15. — Vol. 109, iss. 1. — P. 67–70. — ISSN 0378-7753. — doi:10.1016/S0378-7753(02)00041-1.