Ферроцен
| Ферроцен | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
бис-η5-циклопентадиенилжелезо(II) |
| Хим. формула | C10H10Fe |
| Физические свойства | |
| Молярная масса | 186.04 г/моль |
| Плотность | 1,49 г/см³ |
| Энергия ионизации | 6,88 ± 0,01 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 173 °C |
| • кипения | 249 °C |
| • разложения | 470 °C |
| Классификация | |
| Рег. номер CAS | 102-54-5 |
| PubChem | 7611 и 504306 |
| Рег. номер EINECS | 203-039-3 |
| SMILES | |
| InChI | |
| RTECS | LK0700000 |
| ChemSpider | 7329 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |


Ферроцен — одно из наиболее известных металлоорганических соединений, представитель класса сэндвичевых соединений (металлоценов). Номенклатурное название: бис-(η5-циклопентадиенил)железо(II) (η5-С5Н5)2Fe.
Оранжевые кристаллы. Ферроцен возгоняется при атмосферном давлении; растворим в органических растворителях, нерастворим в воде; устойчив к действию воздуха, горячей концентрированной соляной кислоты и растворам щелочей.
Открытие
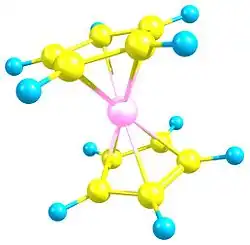
В 1951 году Т. Кили и П. Посон, провели реакцию C5H5MgBr c хлоридом железа FeCl3 с целью синтезировать новый углеводород — дициклопентадиенил. Неожиданно они получили совершенно новое, исключительно устойчивое жёлто-оранжевое кристаллическое соединение, содержащее железо. Потребовалось около года, чтобы понять, как оно построено. Было обнаружено, что атом железа расположен посередине между двумя симметричными пятичленными кольцами C5H5. Пятичленные кольца в молекуле свободно вращаются вокруг оси, соединяющей центры колец. Такой тип структуры получил название «сэндвичевый». Из-за сходства реакционной способности с бензолом, новое соединение было названо «ферроцен» (звуковая аналогия очевидна в английском языке: benzene — ferrocene). Структура ферроцена была установлена в 1952 году Р. Вудвордом и Дж. Уилкинсоном на основании его реакционной способности, и независимо от них — Э. Фишером на основании рентгеноструктурных данных.
Свойства
Многими исследователями было показано, что по общему характеру реакционной способности ферроцен напоминает бензол; это привело к тому, что очень скоро после открытия ферроцен был назван небензоидной ароматической системой. Для него характерны три типа химических превращений: замещение водорода в С5Н5-кольцах без разрыва связей Fe—Cp (Cp=С5Н5), окисление по атому Fe и разрыв связи Fe—Cp.
Реакции электрофильного замещения для ферроцена протекают легче, чем для бензола; при этом образуются как моно-, так и гетероаннулярные (содержащие заместители в разных циклах) дизамещённые производные.
Ферроцен легко и обратимо окисляется до катион-радикала ферроцения (кислородом воздуха в кислой среде, перекисью водорода, иодом, хлоридом железа(III) и т. п.). При окислении не происходит заметных изменений в геометрии молекулы ферроцена. Разбавленные растворы солей ферроцения окрашены в синий цвет, концентрированные — в красный.
Связь Fe—Ср в ферроцене мало реакционноспособна и разрывается только при действии очень сильных восстановителей: водорода в присутствии катализатора (никель Ренея) (300 °C, 2.5 МПа) либо растворов щелочных металлов в жидком аммиаке или аминах. При взаимодействии ферроцена с аренами в присутствии AlCl3/Al одно кольцо замещается на арен и образуется катион [Fe(С5Н5)(Ar)]+.
Получение
- Реакция хлорида железа с реактивом Гриньяра:
- Реакция циклопентадиена с пентакарбонилом железа:
- Реакция циклопентадиена с хлоридом железа и диэтиламином:
Применение
Ферроцен используется в нефтяной промышленности в качестве антидетонатора. Применяется как термостабилизатор полиэтилена и диеновых каучуков (например, бутадиеновых); используется в синтезе некоторых медицинских препаратов.
Примечания
Литература
- Фишер Э., Вернер Г. «π-комплексы металлов», М.: Мир, 1968.
- Посон П. «Химия металлоорганических соединений», М.: Мир, 1970.
- Губин С. П., Шульпин Г. Б. «Химия комплексов со связями металл — углерод», Новосибирск, Наука, 1984.