Фторлимонная кислота
| Фторлимонная кислота | |
|---|---|
 | |
| Общие | |
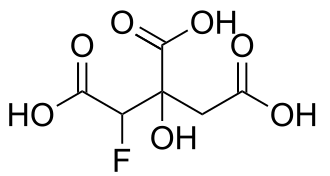
| Систематическое наименование |
1-фтор-2-гидроксипропан-1,2,3-трикарбоновая кислота |
| Традиционные названия | фторлимонная кислота, фторцитрат |
| Хим. формула | С6H7FO7 |
| Физические свойства | |
| Молярная масса | 210,11 г/моль |
| Плотность | 1,37 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 35,2 °C |
| • кипения | 165 °C |
| Классификация | |
| Рег. номер CAS | 357-89-1 |
| PubChem | 107647 |
| SMILES | |
| InChI | |
| ChEBI | 174045 |
| ChemSpider | 96829 |
| Безопасность | |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фторлимонная кислота — фторсодержащая карбоновая кислота, являющаяся результатом замещения одного атома водорода в молекуле лимонной кислоты атомом фтора. Соответствующий анион носит название фторцитрат. В организме синтезируется в результате двухступенчатого метаболизма фторуксусной кислоты. Сначала в митохондрии клетки преобразуется в фторацетил-КоА воздействием фермента ацетил-КоА — синтетазы.[1] Далее происходит конденсация фторацетил-КоА и щавелевоуксусной кислоты, катализируемая ферментом цитратсинтазой, результатом которой является фторлимонная кислота. Фторлимонная кислота является крайне токсичным соединением. Занимает место лимонной кислоты в качестве субстрата фермента аконитазы в цикле трикарбоновых кислот. Фермент, неспособный метаболизировать фторлимонную кислоту, ингибируется и цикл перестает работать.[2] Метаболическое образование фторлимонной кислоты из фторуксусной является классическим примером летального синтеза, описанным Рудольфом Питерсом.
Литература
- Rudolph A. Peters. Biochemical lesions and lethal synthesis. — Oxford-L., 1963.
Ссылки
- ↑ H., Garrett, Reginald. Biochemistry (неопр.). — 5th. — Belmont, CA: Brooks/Cole, Cengage Learning, 2013. — ISBN 9781133106296. Архивировано 13 апреля 2020 года.
- ↑ Horák, J.; Linhart, I.; Klusoň, P. Úvod do toxikologie a ekologie pro chemiky (чешск.). — 1st. — Prague: VŠCHT v Praze, 2004. — ISBN 80-7080-548-X.
