Изотопы фтора
Изото́пы фто́ра — разновидности химического элемента фтора, имеющие разное количество нейтронов в атомном ядре. Известны изотопы фтора с массовыми числами от 14 до 31 (количество протонов 9, нейтронов от 5 до 22) и 2 ядерных изомера.
Единственным стабильным изотопом фтора является 19F, его природная изотопная распространённость равна 100 %[1]. Таким образом, фтор — моноизотопный элемент. Самым долгоживущим радиоизотопом является 18F с периодом полураспада 110 минут.
Фтор-18
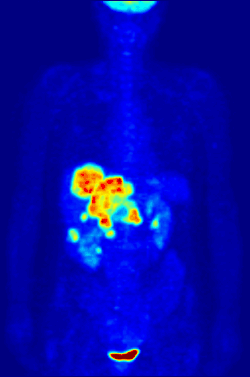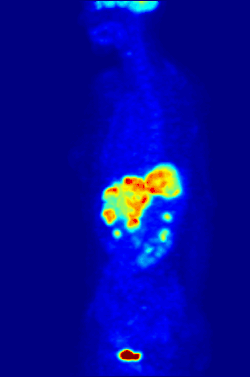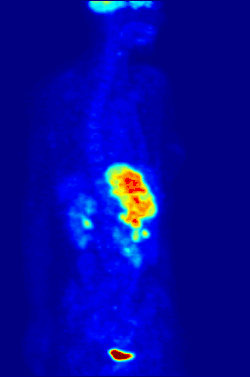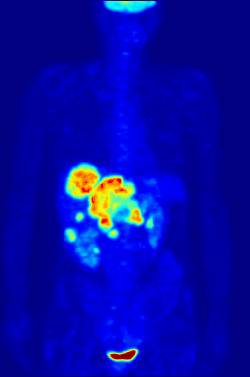
Изотоп 18F является источником позитронов. Используется в ядерной медицине в качестве маркера в диагностических фармпрепаратах фтора, таких как фтордезоксиглюкоза (ФДГ), фторид натрия, фторэтил-L-тирозин способом позитронно-эмиссионной томографии.[2] Изотоп обладает оптимальным периодом полураспада и умеренной энергией излучения для минимизации ущерба пациенту. Короткий период полураспада (110 минут) требует высокой скорости синтеза и доставки препарата пациенту, поэтому ускоритель и фармацевтическая лаборатория строятся в непосредственной близости к медицинскому учреждению.
Активность 3,52⋅1018 Бк/грамм. ~97 % распадов идет по каналу позитронного распада, ~3 % по каналу захвата электрона. В обоих случаях дочерний изотоп 18O. При позитронном распаде максимальная энергия позитронов 0,63 МэВ, средняя 0,25 МэВ[3][4]. При аннигиляции позитрона с электроном образуются два гамма-кванта с энергией 511 кэВ.
18F синтезируют на ускорителях, облучая мишень 18O протонами. Химически мишенью обычно является вода (природного изотопного состава или обогащённая по изотопу 18O). В медицинских учреждениях обычно используют циклотроны, реже линейные ускорители.
В России действует несколько медицинских центров, выполняющих синтез 18F и диагностику с использованием его препаратов[2][5][6].
Радиоактивные свойства
Радиоактивные свойства некоторых изотопов фтора представлены в таблице:
| Массовое число | Реакция получения[7] | Период полураспада[1] | Тип распада |
|---|---|---|---|
| 17 | 9Be(14N,6He); 14N(14N,11B); 14N(α,n); 16O(d,n); 16O(p,γ), 16O(14N,13C); 19F(γ,2n) | 64,49 с | β+ |
| 18 | 9Be(14N,5He); 14N(14N,10B); 16O(α,pn); 18O(p,n); 19F(n,2n); 19F(d,T) | 109,771 мин | β+ |
| 20 | 19F(d,p); 19F(n,γ); 23Na(n,α) | 11,163 с | β−, γ |
| 21 | F(T,p) | 4,158 с | β−, γ |
Таблица изотопов фтора
| Символ нуклида |
Z (p) | N (n) | Масса изотопа[8] (а. е. м.) |
Период полураспада[9] (T1/2) |
Канал распада | Продукт распада | Спин и чётность ядра[9] |
Распространённость изотопа в природе |
Диапазон изменения изотопной распространённости в природе |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | |||||||||
| 13F[10] | 9 | 4 | p | 12O | |||||
| 14F | 9 | 5 | 14,03432(4) | 500(60)⋅10−24 с [910 кэВ] |
p | 13O | 2− | ||
| 15F | 9 | 6 | 15,017785(15) | 1,1(0,3)⋅10−21 с [1,0(2) МэВ] |
p | 14O | 1/2+ | ||
| 16F | 9 | 7 | 16,011466(9) | 11(6)⋅10−21 с [40(20) кэВ] |
p | 15O | 0− | ||
| 17F | 9 | 8 | 17,00209524(27) | 64,370(27) с | β+ | 17O | 5/2+ | ||
| 18F | 9 | 9 | 18,0009373(5) | 109,739(9) мин | β+ (96,86 %) | 18O | 1+ | ||
| ЭЗ (3,14 %) | 18O | ||||||||
| 18mF | 1121,36(15) кэВ | 162(7) нс | ИП | 18F | 5+ | ||||
| 19F | 9 | 10 | 18,9984031629(9) | стабилен | 1/2+ | 1,0000 | |||
| 20F | 9 | 11 | 19,99998125(3) | 11,163(8) с | β− | 20Ne | 2+ | ||
| 21F | 9 | 12 | 20,9999489(19) | 4,158(20) с | β− | 21Ne | 5/2+ | ||
| 22F | 9 | 13 | 22,002999(13) | 4,23(4) с | β− (89 %) | 22Ne | (4+) | ||
| β−, n (11 %) | 21Ne | ||||||||
| 23F | 9 | 14 | 23,00353(4) | 2,23(14) с | β− (86 %) | 23Ne | 5/2+ | ||
| β−, n (14 %) | 22Ne | ||||||||
| 24F | 9 | 15 | 24,00810(10) | 384(16) мс | β− (94,1 %) | 24Ne | 3+ | ||
| β−, n (5,9 %) | 23Ne | ||||||||
| 25F | 9 | 16 | 25,01217(10) | 80(9) мс | β− (76,9 %) | 25Ne | (5/2+) | ||
| β−, n (23,1 %) | 24Ne | ||||||||
| 26F | 9 | 17 | 26,02002(12) | 8,2(9) мс | β− (86,5 %) | 26Ne | 1+ | ||
| β−, n (13,5 %) | 25Ne | ||||||||
| 26mF | 643,4(1) кэВ | 2,2(1) мс | ИП (82 %) | 26F | (4+) | ||||
| β−, n (12 %) | 25Ne | ||||||||
| β− (6 %) | 26Ne | ||||||||
| 27F | 9 | 18 | 27,02732(42) | 4,9(2) мс | β−, n (77 %) | 26Ne | 5/2+# | ||
| β− (23 %) | 27Ne | ||||||||
| 28F | 9 | 19 | 28,03622(42) | 46⋅10−21 с | n | 27F | |||
| 29F | 9 | 20 | 29,04310(56) | 2,5(3) мс | β−, n (60 %) | 28Ne | 5/2+# | ||
| β− (40 %) | 29Ne | ||||||||
| 31F | 9 | 22 | 31,06027(59)# | 1# мс [>260 нс] | β− | 31Ne | 5/2+# | ||
Пояснения к таблице
- Распространённость изотопов приведена для большинства природных образцов.
- Индексами 'm', 'n', 'p' (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Литература
- Николаев Н. С., Суворова С. Н., Гурович Е. И., Пека И., Корчемная Е. К.,. Аналитическая химия фтора. — М.: Наука, 1970. — 196 с. — (Аналитическая химия элементов). — 2750 экз.
- Fowler J. S. and Wolf A. P. (1982) The synthesis of carbon-11, fluorine-18 and nitrogen-13 labeled radiotracers for biomedical applications. Nucl. Sci. Ser. Natl Acad. Sci. Natl Res. Council Monogr. 1982.
Примечания
- 1 2 Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — .
- 1 2 ФГБУ РНЦРХТ, Отделение циклотронных радиофармпрепаратов. Дата обращения: 23 мая 2018. Архивировано из оригинала 24 мая 2018 года.
- ↑ Clinical Applications of Gallium-68. Дата обращения: 22 мая 2019. Архивировано 17 марта 2020 года.
- ↑ Данные по 18F из Nuclear Data Services (International Atomic Energy Agency) (недоступная ссылка) (англ.)
- ↑ В Москве построят циклотрон для медицинских целей. Дата обращения: 23 мая 2018. Архивировано 24 мая 2018 года.
- ↑ Комплекс по производству РФП. Дата обращения: 23 мая 2018. Архивировано из оригинала 24 мая 2018 года.
- ↑ Николаев Н.С., Суворова С.Н., Гурович Е.И., Пека И., Корчемная Е.К.,. Аналитическая химия фтора. — М.: Наука, 1970. — 196 с. — (Аналитическая химия элементов). — 2750 экз.
- ↑ Данные приведены по Wang M., Audi G., Kondev F. G., Huang W. J., Naimi S., Xu X. The Ame2016 atomic mass evaluation (I). Evaluation of input data; and adjustment procedures (англ.) // Chinese Physics C. — 2016. — Vol. 41, iss. 3. — P. 030002-1—030002-344. — doi:10.1088/1674-1137/41/3/030002.
- 1 2 Данные приведены по Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — doi:10.1088/1674-1137/41/3/030001. — .
- ↑ Charity R. J. et al. Observation of the Exotic Isotope 13F Located Four Neutrons beyond the Proton Drip Line (англ.) // Physical Review Letters. — 2021. — Vol. 126, iss. 13. — P. 2501. — doi:10.1103/PhysRevLett.126.132501. Архивировано 13 мая 2022 года.