Хлорат бария
| Хлорат бария | |
|---|---|
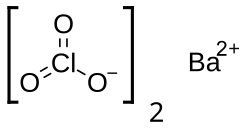 | |
| Общие | |
| Систематическое наименование |
Хлорат бария |
| Хим. формула | Ba(ClO3)2 |
| Физические свойства | |
| Состояние | твердый |
| Молярная масса | 304,23 г/моль |
| Плотность | 3,18 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 414 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | (при 20 °C) 25,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13477-00-4 |
| PubChem | 26059 |
| Рег. номер EINECS | 236-760-7 |
| SMILES | |
| InChI | |
| RTECS | FN9770000 |
| ChemSpider | 24273 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлора́т ба́рия — бариевая соль хлорноватой кислоты, имеющая химическую формулу Ba(ClO3)2.
Физические и химические свойства
Соединение представляет белый моноклинный кристаллический порошок [1] хорошо растворимый в воде. В обычном состоянии существует в виде моногидрата Ba(ClO3)2•H2O[2]. При температуре свыше 120 °C теряет кристаллизационную воду, а при сильном нагревании разлагается:
Ba(ClO3)2 = BaCl2 + 3O2↑
Хлорат бария — сильный окислитель. При трении, ударе и нагревании в смеси с горючими веществами взрывоопасен[2]. Ядовит.
Получение
Электролитический метод
Хлорат бария получают электролитическим окислением раствора хлорида бария при нагревании:
BaCl2 + 2H2O = Ba(OH)2 + H2↑ + Cl2↑
6Ba(OH)2 + 6Cl2 = 5BaCl2 + Ba(ClO3)2 + 6H2O
Недостаток метода заключается в необходимости дальнейшего отделения хлората бария от примесей хлорида.
Обменный метод[3]
На первой стадии получают аммониевую соль винной кислоты (тартрат аммония):
HOOC-CH(OH)-CH(OH)-COOH + NH4OH = HOOC-CH(OH)-CH(OH)-COONH4 + H2O
Далее приливают при охлаждении раствор хлората калия и отделяют выпавший осадок тартрата калия:
HOOC-CH(OH)-CH(OH)-COONH4 + KClO3 = HOOC-CH(OH)-CH(OH)-COOK↓ + NH4ClO3
Образовавшийся хлорат аммония добавляют к карбонату бария и кипятят до окончания выделения аммиака:
2NH4ClO3 + BaCO3 = Ba(ClO3)2 + 2NH3↑ + CO2↑ + H2O
Применение
Используется как энергичный окислитель, источник зеленого цвета и донор хлора в пиротехнических составах. Имеются данные о возможности использования хлората бария в сельском хозяйстве как гербицида[4].
Примечания
- ↑ XuMuK.ru — Бария хлорат моногидрат. Мини-справочник по химическим веществам (3340 веществ)
- 1 2 Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко. Аналитическая химия бария (неопр.). — Москва: Наука, 1977.
- ↑ https://web.archive.org/web/20000516085848/http://www.geocities.com/CapeCanaveral/Campus/5361/chlorate/barium.html
- ↑ С.И. Венецкий. О редких и рассеянных (неопр.). — Москва: Металлургия, 1980.
