Хромат калия
| Хромат калия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Хромат калия |
| Традиционные названия | Хромовокислый калий |
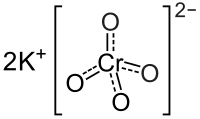
| Хим. формула | K2CrO4 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 194,19 г/моль |
| Плотность | 2,732 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 968,3; 973 °C |
| • кипения | 1000 °C[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 63,020; 75,180; 79,2100 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,74 |
| Классификация | |
| Рег. номер CAS | 7789-00-6 |
| PubChem | 24597 |
| Рег. номер EINECS | 232-140-5 |
| SMILES | |
| InChI | |
| RTECS | GB2940000 |
| ChEBI | 75249 |
| ChemSpider | 22999 |
| Безопасность | |
| Токсичность | яд и канцероген |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромат калия — неорганическое соединение, соль металла калия и хромовой кислоты с формулой K2CrO4, жёлтые кристаллы, растворимые в воде, окрашивает раствор, как и многие другие хроматы, в желтый цвет.
Получение
- В природе встречается редкий минерал тарапакаит — хромат калия с примесями.
- Окисление оксида хрома(III) хлоратом калия:
- Растворение оксида хрома(VI) в едком кали:
- Разложение бихромата калия при нагревании:
- Действие концентрированного раствора едкого кали на дихромат калия:
Физические свойства
Хромат калия образует жёлтые кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,761 нм, b = 1,040 нм, c = 0,592 нм, Z = 4.
При 668°С переходит в гексагональную красную фазу.
Хорошо растворяется в воде с гидролизом по аниону. Плохо растворим в этаноле.
Химические свойства
- В разбавленных кислотах переходит в дихромат калия:
- С концентрированными кислотами реакция идёт иначе:
- С концентрированными горячими кислотами проявляются окислительные свойства:
- Вступает в обменные реакции:
Применение
- В качестве поглотителя УФ излучения лампы накачки в твердотельных лазерах для предотвращения деградации активной среды.
- Как протрава при крашении тканей.
- Окрашивание стекла в жёлтый цвет.
- Дубитель в кожевенной промышленности.
- Отбеливатель для масла и воска.
- Окислитель в органическом синтезе.
- Хромат калия используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Токсичность
Хромат калия очень ядовит и канцерогенен, как и многие другие соединения шестивалентного хрома.
Примечания
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
