Хромат цинка
| Хромат цинка | |
|---|---|
 | |
| Общие | |
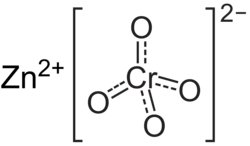
| Хим. формула | CrO4Zn |
| Физические свойства | |
| Молярная масса | 181,403 г/моль |
| Плотность | 3,43 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 316 °C |
| • кипения | 732 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| Классификация | |
| Рег. номер CAS | 13530-65-9 |
| PubChem | 26089 |
| Рег. номер EINECS | 236-878-9 |
| SMILES | |
| InChI | |
| RTECS | GB3290000 |
| ChemSpider | 24301 |
| Безопасность | |
| ЛД50 | от 500 до 5000 мг/кг |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромат цинка (монохромат цинка, тетрооксихромат цинка)- неорганическая соль цинка и хромовой кислоты желтого цвета. Является сильным окислителем.
Физические свойства
Это желтое кристаллическое вещество без запаха, тонет в воде. Не растворимое в холодной воде, частично растворимо в горячей воде, хорошо растворимо в жидком аммиаке.[1]
Получение
Для получения хромата цинка, растворяют оксид цинка в концентрированном водном растворе хромового ангидрида, при нагревании. Осадок отделяют от основного раствора и растворяют его при нагревании в уксусной кислоте. Полученный раствор приливают к основному раствору и добавляют ацетат цинка, получается уксусный раствор монохромата цинка. Затем раствор упаривают.[2] В простом виде уравнение реакции выглядит следующим образом:
ZnO+CrO3 → ZnCrO4
Или из дихромата цинка:
ZnCr2O7+2NaOH → Na2CrO4+ZnCrO4↓+H2O
Химические свойства
Взаимодействует с концентрированной серной кислотой с образованием дихромата цинка:
2ZnCrO4 + H2SO4 → ZnCr2O7 + ZnSO4 + H2O
Реакция с разбавленной щелочью:
ZnCrO4 + 2NaOH → Na2CrO4 + Zn(OH)2↓
Реакция обмена:
ZnCrO4 + BaCl2 → ZnCl2 + BaCrO4↓
Разложение:
4ZnCrO4 → 4ZnO + 2Cr2O3 + 3O2↑
Применение
Токсичность
В данном соединение хром проявляет самую опасную степень окисления +6. Хром (VI) наиболее токсичная степень окисления из-за его способности легко проникать в клетки живого организма. Также он имеет более высокий окислительно-восстановительный потенциал. В первую очередь хромат цинка поражает легкие, вызывая одышку, бронхит, пневмонию и астму. Также воздействует на печень, почки, желудочно-кишечный тракт и иммунную систему. Вещество является канцерогеном, способствует развитию рака легких и рака придаточных пазух носа.[4]
Примечания
- ↑ PubChem. Zinc Chromate (англ.). pubchem.ncbi.nlm.nih.gov. Дата обращения: 18 ноября 2024.
- ↑ SU537035A1 - Способ получения монохромата цинка - Яндекс.Патенты. yandex.ru. Дата обращения: 18 ноября 2024.
- ↑ YELLOWZINC. www.chembk.com. Дата обращения: 18 ноября 2024.
- 1 2 Zinc chromate | 13530-65-9, Zinc chromate Formula (англ.). ECHEMI. Дата обращения: 18 ноября 2024.
