BUB1
Митотическая контрольная точка серин/треонин-протеинкиназы BUB1 (англ. Mitotic checkpoint serine/threonine-protein kinase BUB1) известная также как BUB1 — фермент, кодируемый у человека геном BUB1[2][3].
Bub1 является серин/треонин-протеинкиназой, впервые выявленной при генетическом скрининге Saccharomyces cerevisiae[4]. Белок связан с кинетохорами и играет ключевую роль в создании митотической контрольной точки веретена деления и конгрессии хромосом. Митотическая контрольная точка киназы эволюционно сохраняется в различных организмах, от Saccharomyces cerevisiae до человека. Потеря функции, мутация или отсутствие Bub1 приводит к анеуплоидии, синдромам хромосомной нестабильности (CIN) и преждевременному старению.
Структура
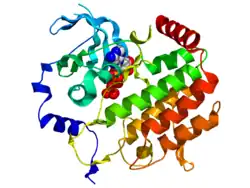
Bub1 содержит консервативный N-терминальный регион, центральный неконсервативный регион и С-концевой домен серин/треонин-киназы[5]. N-терминальный регион опосредованное связывание HS-BUB1 с митотической кинетохорой белка AF15q14. Последнее взаимодействие имеет важное значение для кинетохорной локализации Bub1 и его функции блокировки индуцированной активации контрольной точки сборки веретена деления(SAC) в клеточного цикле[6]. Кристаллическая структура человеческого Bub1 показывает наличие N-концевого тетратрикопептидного повтора домена (TPR) и С-концевой киназы домена (остатки 784—1085), имеющей вид канонической киназы с двумя лопастями. АТФ-связываемые и каталитические сайты расположены на границе двух долей. Расширение N-конца содержит три β-листа и α-спираль, обернутые вокруг N-доли киназы домена[1].
Внутриклеточная локализация
В организме человека Bub1 накапливается постепенно в течение G1 и S-фаз клеточного цикла, пики на G2/M, и резко падает после митоза. В профазе он локализуется в одном из первых белков в наружном слое кинетохора, процесс обычно вовлекается в корректный тайминг митотической и ответной контрольных точек повреждения веретена.
Функция
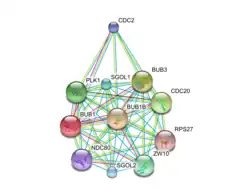
Протеинкиназа Bub1 обладает различными универсальными функциями в ходе клеточного цикла, в основном, в SAC и хромосомного выравнивания во время метафазы. Сетевое взаимодействие белка в настоящее время определены комплексным образом (рисунок 1).
В эукариотических клетках SAC служит в качестве центрального механизма наблюдения для обеспечения передачи хромосом следующему поколению надежным способом. Некоторые компоненты контролируют правильность биполярного прикрепления микротрубочек к кинетохорам, предположительно посредством обнаружения напряжения. Переход от метафазы к анафазе остановливается SAC тех пор, пока не появится достаточного количества одиночных кинетохор для биполярного вложение микротрубочек; здесь подразумевая необходимость высокочувствительного сигнального пути.
Bub1 — главный регулятор формирования SAC и сигнализации. По крайней мере, тринадцать других белков (MAD1, MAD2, MAD3/BubR1, BUB3, Mps1 и т. д.) являются частью контрольной точки, среди которых многие были идентифицированы в качестве агентов для взаимодействовать с Bub1.
После активации SAC Bub1 непосредственно фосфорилирует коактиватор APC/C в CDC20[8]. Это событие фосфорилирования, вероятно, достигается в комплексе с Bub3, который сам по себе был подвергнут предварительному фосфорилирования Bub1. Фосфорилирование Cdc20 в конечном счете, приводит к снижению активности APC/C, которая определяет переход от метафазы к анафазе. В свою очередь APC/C, теперь уже в комплексе с CDH1, также действует на Bub1 главным образом для деградации, чтобы выйти в митоз[9].
Кроме того, локализация кинетохор Bub1 в начале G2 или профазы — ещё один аспект функционирования SAC. Bub1, как полагают, служит в качестве платформы рекрутирования других контрольных точек и моторных белков, таких как MAD1, Mad2, BubR1, CENP-E и PLK1 кинетохорам[10][11][12]. В самом деле, последние данные показывают, что основная роль Bub1 в деятельности SAC не фосфорилирование CDC20, а рекрутирование BubR1, Mad1 и Mad2[13].
При повреждении веретена Bub1 также переключается на фосфорилирование MAD1[14][15], приводя к диссоциации комплекса MAD1-Mad2 и, тем самым делая доступным для Mad2 ингибирование Cdc20. Bub1 в целом защищает сестринские хроматидные сплоченности путём усиления белка Шугошин(англ. Shugoshin) (Sgo1), локализованного в центромерном регионе. Путём рекрутирования фосфатазы PP2A Bub1 ингибирует действие PLK1, который удаляет Sgo1 из центромеры[16][17][18][19].
Противоположная локализация PLK1, как уже упоминалось, также зависит от активности Bub1. Исследования экстракций, проведенные с Xenopus с использованием RNAi или истощением антител, показали решающую функцию Bub1 в организации внутренней центромеры. Подобно своей роли в сборке кинетохор, он рекрутирует членов хромосомного пассажирского комплекса (CPC), подобно киназе Aurora B, сурвивину и INCENP. Наблюдается также прямое фосфорилирование INCENP посредством Bub1[20].
Опосредованое РНК истощение человеческого Bub1 показывает его функцию в правильной конгрессии метафазы. Нижерасположенные цели, определённые в различных кинетохорах — белки CENPF, KIF2C и указанный выше Sgo1[13].
Последствия при раке
Дефекты митотических контрольных точек являются общей чертой многих раковых заболеваний человека. Мутация в контрольных точках веретена может привести к хромосомной нестабильности и анеуплоидии, элементам, представленным в более чем 90 % всех солидных опухолей[21]. Потери функций в результате мутации или снижение экспрессии гена Bub1 были выявлены в нескольких опухолях человека, таких как рак толстой кишки, пищевода, желудка, молочной железы, и меланомы[13]. Была найдена корреляция между уровнями экспрессии Bub1 и локализацией опухолей, в зависимости от их тяжести. Например, низкие уровни экспрессии Bub1 приводят к саркоме, лимфоме и опухоли легких, тогда как более высокие из них вызывают саркомы и опухоли в печени[22]. Кроме того, Bub1 был идентифицирован как цель большого Т-антигена вируса SV-40, возможно, способствуя своим потенциалом для опухолевой трансформации[23]. Показания для возможного участия Bub1 в онкогенезе также получены из экспериментов на животных, где мыши при уменьшением экспрессии Bub1 показали увеличение восприимчивости опухоли[24][25]. Нокдаун In vitro Bub1 вызвавший в p53 нарушение клеток (например, HeLa клеток) приводил к анеуплоидии[26]. Является ли достаточной причиной анеуплоидии вождение во время онкогенеза или, скорее, просто его следствием, был вопросом научных дискуссий.
Связь с каспазо-независимым миотическим отмиранием (CIMD)
Недавно Bub1 был идентифицирован как негативный регулятор CIMD. Истощение Bub1 приводит к увеличению CIMD во избежание анеуплоидии, обусловливая снижение функционирования SAC. Транскрипционная активность p73, таким образом, ингибируется с помощью фосфорилирования. Непосредственное взаимодействие между этими двумя игроками не визуализировано до сих пор, поэтому молекулы связывающие Bub1 и р73 ещё предстоит определить[27]. Кроме того, предполагается, что Bub1 связывается с р53, чтобы предотвратить активацию проапоптозных генов, поэтому р53 способен индуцировать апоптоз, когда исчерпан Bub1. Тем не менее, взаимодействие между р53 и Bub1 ещё не было выявлено, в то время как поступала информация о связывание гена р53 и BubR1[28].
См. также
Примечания
- 1 2 PDB 3E7E; Kang J., Yang M., Li B., Qi W., Zhang C., Shokat K.M., Tomchick D.R., Machius M., Yu H. Structure and substrate recruitment of the human spindle checkpoint kinase Bub1 (англ.) // Mol. Cell : journal. — 2008. — November (vol. 32, no. 3). — P. 394—405. — doi:10.1016/j.molcel.2008.09.017. — PMID 18995837. — PMC 2644263.
- ↑ Entrez Gene: BUB1 BUB1 budding uninhibited by benzimidazoles 1 homolog (yeast).
- ↑ Cahill D.P., Lengauer C., Yu J., Riggins G.J., Willson J.K., Markowitz S.D., Kinzler K.W., Vogelstein B. Mutations of mitotic checkpoint genes in human cancers (англ.) // Nature : journal. — 1998. — March (vol. 392, no. 6673). — P. 300—303. — doi:10.1038/32688. — PMID 9521327.
- ↑ Roberts B.T., Farr K.A., Hoyt M.A. The Saccharomyces cerevisiae checkpoint gene BUB1 encodes a novel protein kinase (англ.) // Molecular and Cellular Biology : journal. — 1994. — December (vol. 14, no. 12). — P. 8282—8291. — PMID 7969164. — PMC 359367.
- ↑ Bolanos-Garcia V.M., Kiyomitsu T., D'Arcy S., Chirgadze D.Y., Grossmann J.G., Matak-Vinkovic D., Venkitaraman A.R., Yanagida M., Robinson C.V., Blundell T.L. The crystal structure of the N-terminal region of BUB1 provides insight into the mechanism of BUB1 recruitment to kinetochores (англ.) // Structure : journal. — 2009. — January (vol. 17, no. 1). — P. 105—116. — doi:10.1016/j.str.2008.10.015. — PMID 19141287. — PMC 2683949.
- ↑ Kiyomitsu T., Obuse C., Yanagida M. Human Blinkin/AF15q14 is required for chromosome alignment and the mitotic checkpoint through direct interaction with Bub1 and BubR1 (англ.) // Developmental Cell : journal. — 2007. — November (vol. 13, no. 5). — P. 663—676. — doi:10.1016/j.devcel.2007.09.005. — PMID 17981135.
- ↑ BUB1 protein (Homo sapiens) - STRING interaction network. STRING (Search Tool for the Retrieval of Interacting Genes/Proteins). European Molecular Biology Laboratory. Дата обращения: 29 июня 2010. Архивировано из оригинала 18 июля 2011 года.
- ↑ Tang Z., Shu H., Oncel D., Chen S., Yu H. Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint (англ.) // Molecular Cell : journal. — 2004. — November (vol. 16, no. 3). — P. 387—397. — doi:10.1016/j.molcel.2004.09.031. — PMID 15525512.
- ↑ Qi W., Yu H. KEN-box-dependent degradation of the Bub1 spindle checkpoint kinase by the anaphase-promoting complex/cyclosome (англ.) // The Journal of Biological Chemistry : journal. — 2007. — February (vol. 282, no. 6). — P. 3672—3679. — doi:10.1074/jbc.M609376200. — PMID 17158872.
- ↑ Sharp-Baker H., Chen R.H. Spindle checkpoint protein Bub1 is required for kinetochore localization of Mad1, Mad2, Bub3, and CENP-E, independently of its kinase activity (англ.) // The Journal of Cell Biology : journal. — 2001. — June (vol. 153, no. 6). — P. 1239—1250. — doi:10.1083/jcb.153.6.1239. — PMID 11402067. — PMC 2192030.
- ↑ Johnson V.L., Scott M.I., Holt S.V., Hussein D., Taylor S.S. Bub1 is required for kinetochore localization of BubR1, Cenp-E, Cenp-F and Mad2, and chromosome congression (англ.) // Journal of Cell Science : journal. — The Company of Biologists, 2004. — March (vol. 117, no. Pt 8). — P. 1577—1589. — doi:10.1242/jcs.01006. — PMID 15020684.
- ↑ Meraldi P., Draviam V.M., Sorger P.K. Timing and checkpoints in the regulation of mitotic progression (англ.) // Developmental Cell : journal. — 2004. — July (vol. 7, no. 1). — P. 45—60. — doi:10.1016/j.devcel.2004.06.006. — PMID 15239953.
- 1 2 3 Klebig C., Korinth D., Meraldi P. Bub1 regulates chromosome segregation in a kinetochore-independent manner (англ.) // The Journal of Cell Biology : journal. — 2009. — June (vol. 185, no. 5). — P. 841—858. — doi:10.1083/jcb.200902128. — PMID 19487456. — PMC 2711590.
- ↑ Yu H. Regulation of APC-Cdc20 by the spindle checkpoint (англ.) // Current Opinion in Cell Biology. — Elsevier, 2002. — December (vol. 14, no. 6). — P. 706—714. — doi:10.1016/S0955-0674(02)00382-4. — PMID 12473343.
- ↑ Zhang Y., Lees E. Identification of an overlapping binding domain on Cdc20 for Mad2 and anaphase-promoting complex: model for spindle checkpoint regulation (англ.) // Molecular and Cellular Biology : journal. — 2001. — August (vol. 21, no. 15). — P. 5190—5199. — doi:10.1128/MCB.21.15.5190-5199.2001. — PMID 11438673. — PMC 87243.
- ↑ Tang Z., Sun Y., Harley S.E., Zou H., Yu H. Human Bub1 protects centromeric sister-chromatid cohesion through Shugoshin during mitosis (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. — December (vol. 101, no. 52). — P. 18012—18017. — doi:10.1073/pnas.0408600102. — PMID 15604152. — PMC 539817.
- ↑ Tang Z., Shu H., Qi W., Mahmood N.A., Mumby M.C., Yu H. PP2A is required for centromeric localization of Sgo1 and proper chromosome segregation (англ.) // Developmental Cell : journal. — 2006. — May (vol. 10, no. 5). — P. 575—585. — doi:10.1016/j.devcel.2006.03.010. — PMID 16580887.
- ↑ Jang Y.J., Ji J.H., Choi Y.C., Ryu C.J., Ko S.Y. Regulation of Polo-like kinase 1 by DNA damage in mitosis. Inhibition of mitotic PLK-1 by protein phosphatase 2A (англ.) // The Journal of Biological Chemistry : journal. — 2007. — January (vol. 282, no. 4). — P. 2473—2482. — doi:10.1074/jbc.M605480200. — PMID 17121863.
- ↑ Pouwels J., Kukkonen A.M., Lan W., Daum J.R., Gorbsky G.J., Stukenberg T., Kallio M.J. Shugoshin 1 plays a central role in kinetochore assembly and is required for kinetochore targeting of Plk1 (англ.) // Cell Cycle : journal. — 2007. — July (vol. 6, no. 13). — P. 1579—1585. — doi:10.4161/cc.6.13.4442. — PMID 17617734.
- ↑ Boyarchuk Y., Salic A., Dasso M., Arnaoutov A. Bub1 is essential for assembly of the functional inner centromere (англ.) // The Journal of Cell Biology : journal. — 2007. — March (vol. 176, no. 7). — P. 919—928. — doi:10.1083/jcb.200609044. — PMID 17389228. — PMC 2064078.
- ↑ Williams B.R., Amon A. Aneuploidy: cancer's fatal flaw? (англ.) // Cancer Research. — American Association for Cancer Research, 2009. — July (vol. 69, no. 13). — P. 5289—5291. — doi:10.1158/0008-5472.CAN-09-0944. — PMID 19549887. — PMC 2917070.
- ↑ King R.W. When 2+2=5: the origins and fates of aneuploid and tetraploid cells (англ.) // Biochimica Et Biophysica Acta : journal. — 2008. — September (vol. 1786, no. 1). — P. 4—14. — doi:10.1016/j.bbcan.2008.07.007. — PMID 18703117. — PMC 2581926.
- ↑ Hein J., Boichuk S., Wu J., Cheng Y., Freire R., Jat P.S., Roberts T.M., Gjoerup O.V. Simian virus 40 large T antigen disrupts genome integrity and activates a DNA damage response via Bub1 binding (англ.) // Journal of Virology : journal. — 2009. — January (vol. 83, no. 1). — P. 117—127. — doi:10.1128/JVI.01515-08. — PMID 18922873. — PMC 2612341.
- ↑ Jeganathan K., Malureanu L., Baker D.J., Abraham S.C., van Deursen J.M. Bub1 mediates cell death in response to chromosome missegregation and acts to suppress spontaneous tumorigenesis (англ.) // The Journal of Cell Biology : journal. — 2007. — October (vol. 179, no. 2). — P. 255—267. — doi:10.1083/jcb.200706015. — PMID 17938250. — PMC 2064762.
- ↑ Schliekelman M., Cowley D.O., O'Quinn R., Oliver T.G., Lu L., Salmon E.D., Van Dyke T. Impaired Bub1 function in vivo compromises tension-dependent checkpoint function leading to aneuploidy and tumorigenesis (англ.) // Cancer Research : journal. — American Association for Cancer Research, 2009. — January (vol. 69, no. 1). — P. 45—54. — doi:10.1158/0008-5472.CAN-07-6330. — PMID 19117986.
- ↑ Williams G.L., Roberts T.M., Gjoerup O.V. Bub1: escapades in a cellular world (англ.) // Cell Cycle : journal. — 2007. — July (vol. 6, no. 14). — P. 1699—1704. — doi:10.4161/cc.6.14.4493. — PMID 17643075.
- ↑ Kitagawa K., Niikura Y. Caspase-independent mitotic death (CIMD) (англ.) // Cell Cycle : journal. — 2008. — April (vol. 7, no. 8). — P. 1001—1005. — doi:10.4161/cc.7.8.5720. — PMID 18414023.
- ↑ Beeharry N., Yen T.J. p53-dependent apoptosis in response to spindle damage is linked to loss of Bub1 (англ.) // Cancer Biology & Therapy : journal. — 2009. — April (vol. 8, no. 7). — P. 645—647. — doi:10.4161/cbt.8.7.8140. — PMID 19270499.