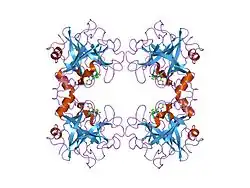
Структура
Триптаза бета-2 состоит из 275 аминокислот, молекулярная масса 30,6 кДа.
Функции
Триптазы входят в семейство S1 трипсино-подобных сериновых протеаз. Они каталитически активны в тетрамерной форме, стабилизируемой гепарином, и устойчивы к известным эндогенным ингибиторам протеаз. Несколько генов триптаз сгруппированы на хромосоме 16p13.3 и обладают некоторыми общими свойствами. Все эти гены имеют высококонсервативные участки 3' UTR и содержат тандемные повторы на 5'-конце, а их 3' UTR участок играет роль в регуляции стабильности их мРНК. Гены содержат интрон непосредственно после инициирующего Met-кодона, отделяющего Met-кодон от кодирующей белок последовательности. Такая особенность структуры гена характерна в основном только для триптаз. Ген TPSB2 отличается множественностью аллелей, две основные из которых бета II и бета III ранее считались отдельными белками. Бета-триптазы - основные нейтральные протеазы, присутствующие в тучных клетках, которые секретируются из клетки в ходе процесса активации-дегрануляции. Может играть роль во врождённом иммунитете[5].
Хотя основные физиологические субстраты бета-триптаз не выяснены, известно, что эти ферменты могут расщеплять несколько потенциально важных белков, включая фибриноген, фибронектин, предшественник матриксной металлопротеиназы про-MMP-3, протеазо-активируемый рецептор PAR2 и компонент комплемента C3[6].
Литература
- Miller JS, Moxley G, Schwartz LB (1990). Cloning and characterization of a second complementary DNA for human tryptase. J. Clin. Invest. 86 (3): 864–70. doi:10.1172/JCI114786. PMC 296804. PMID 2203827.
- Hallgren J, Lindahl S, Pejler G (2005). Structural requirements and mechanism for heparin-dependent activation and tetramerization of human betaI- and betaII-tryptase. J. Mol. Biol. 345 (1): 129–39. doi:10.1016/j.jmb.2004.10.029. PMID 15567416.
- Sommerhoff CP, Bode W, Matschiner G, et al. (2000). The human mast cell tryptase tetramer: a fascinating riddle solved by structure. Biochim. Biophys. Acta. 1477 (1–2): 75–89. doi:10.1016/s0167-4838(99)00265-4. PMID 10708850.
- Huang C, Li L, Krilis SA, et al. (1999). Human tryptases alpha and beta/II are functionally distinct due, in part, to a single amino acid difference in one of the surface loops that forms the substrate-binding cleft. J. Biol. Chem. 274 (28): 19670–6. doi:10.1074/jbc.274.28.19670. PMID 10391906.
- Caughey GH, Raymond WW, Blount JL, et al. (2000). Characterization of human gamma-tryptases, novel members of the chromosome 16p mast cell tryptase and prostasin gene families. J. Immunol. 164 (12): 6566–75. doi:10.4049/jimmunol.164.12.6566. PMID 10843716.
- Vanderslice P, Ballinger SM, Tam EK, et al. (1990). Human mast cell tryptase: multiple cDNAs and genes reveal a multigene serine protease family. Proc. Natl. Acad. Sci. U.S.A. 87 (10): 3811–5. doi:10.1073/pnas.87.10.3811. PMC 53993. PMID 2187193.
- Guida M, Riedy M, Lee D, Hall J (2000). Characterization of two highly polymorphic human tryptase loci and comparison with a newly discovered monkey tryptase ortholog. Pharmacogenetics. 10 (5): 389–96. doi:10.1097/00008571-200007000-00002. PMID 10898108.
- Gerhard DS, Wagner L, Feingold EA, et al. (2004). The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC). Genome Res. 14 (10B): 2121–7. doi:10.1101/gr.2596504. PMC 528928. PMID 15489334.
- Blom T, Hellman L (1993). Characterization of a tryptase mRNA expressed in the human basophil cell line KU812. Scand. J. Immunol. 37 (2): 203–8. doi:10.1111/j.1365-3083.1993.tb01757.x. PMID 8434231.
- Pallaoro M, Fejzo MS, Shayesteh L, et al. (1999). Characterization of genes encoding known and novel human mast cell tryptases on chromosome 16p13.3. J. Biol. Chem. 274 (6): 3355–62. doi:10.1074/jbc.274.6.3355. PMID 9920877.
- Caughey GH (2002). New developments in the genetics and activation of mast cell proteases. Mol. Immunol. 38 (16–18): 1353–7. doi:10.1016/S0161-5890(02)00087-1. PMID 12217407.
- Akin C, Soto D, Brittain E, et al. (2007). Tryptase haplotype in mastocytosis: relationship to disease variant and diagnostic utility of total tryptase levels. Clin. Immunol. 123 (3): 268–71. doi:10.1016/j.clim.2007.02.007. PMC 1949411. PMID 17449330.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2002). Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences. Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899–903. doi:10.1073/pnas.242603899. PMC 139241. PMID 12477932.
- Sommerhoff CP, Bode W, Pereira PJ, et al. (1999). The structure of the human betaII-tryptase tetramer: fo(u)r better or worse. Proc. Natl. Acad. Sci. U.S.A. 96 (20): 10984–91. doi:10.1073/pnas.96.20.10984. PMC 34230. PMID 10500112.
- Daniels RJ, Peden JF, Lloyd C, et al. (2001). Sequence, structure and pathology of the fully annotated terminal 2 Mb of the short arm of human chromosome 16. Hum. Mol. Genet. 10 (4): 339–52. doi:10.1093/hmg/10.4.339. PMID 11157797.
- Trivedi NN, Tamraz B, Chu C, et al. (2009). Human subjects are protected from mast cell tryptase deficiency despite frequent inheritance of loss-of-function mutations. J. Allergy Clin. Immunol. 124 (5): 1099—1105.e4. doi:10.1016/j.jaci.2009.07.026. PMC 2783561. PMID 19748655.
- Pereira PJ, Bergner A, Macedo-Ribeiro S, et al. (1998). Human beta-tryptase is a ring-like tetramer with active sites facing a central pore. Nature. 392 (6673): 306–11. doi:10.1038/32703. PMID 9521329.
- Wu C, Ma MH, Brown KR, et al. (2007). Systematic identification of SH3 domain-mediated human protein-protein interactions by peptide array target screening. Proteomics. 7 (11): 1775–85. doi:10.1002/pmic.200601006. PMID 17474147.