Азотноватистая кислота
| Азотноватистая кислота | |
|---|---|
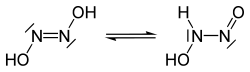 | |
| Общие | |
| Систематическое наименование |
Азотноватистая кислота |
| Хим. формула | H2N2O2 |
| Внешний вид | Бесцветные кристаллы |
| Физические свойства | |
| Состояние | твёрдая |
| Молярная масса | 62,03 г/моль |
| Термические свойства | |
| Температура | |
| • разложения | 25 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 7 |
| Классификация | |
| Рег. номер CAS | 14448-38-5 |
| PubChem | 61744, 135398676, 135476779 и 135496072 |
| SMILES | |
| InChI | |
| ChEBI | 14428 |
| ChemSpider | 55636 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Азотнова́тистая кислота́ — слабая, неустойчивая неорганическая кислота. Образует соли — гипонитриты. Является изомером нитрамида.
История
Азотноватистая кислота была открыта и получена в 1893 году немецким химиком Иоганном Вислицениусом[1].
Строение и свойства
Молекула азотноватистой кислоты имеет строение HO-N=N-OH. При нормальных условиях представляет собой гигроскопичные бесцветные кристаллы. Гидроксогруппы находятся в транс-положении к двойной связи. Растворима в воде, этаноле и диэтиловом эфире.
Получение
Реакцией сухого хлороводорода в диэтиловом эфире с гипонитритом серебра.
Описана реакция азотистой кислоты с гидроксиламином, которая с низким выходом даёт азотноватистую кислоту:
Свойства
Разлагается при небольшом нагревании до закиси азота и воды. Разложение может протекать со взрывом.
Слабая кислота (pKa (1) = 7, pKa (2) = 11). С щелочами даёт соли, называемые гипонитритами. Жёлтый гипонитрит серебра мало растворим в воде. Водные растворы неустойчивы в диапазоне рН 4—14 из-за катализируемого основанием разложения до закиси азота. В более кислых средах разложение происходит медленнее (период полураспада дни и недели).
Взрывоопасна. Окисляется на воздухе или под действием иода до азотистой и азотной кислот, под действием перманганата калия — до азотной кислоты. Реагирует с азотистой кислотой с образованием азотной кислоты, азота и воды. С трудом восстанавливается водородом до гидразина.
Литература
- Химическая энциклопедия. Т. 1. — М.: Советская энциклопедия, 1988. — С. 63.
- Гринвуд Н., Эрншо А. Химия элементов. Т. 1. — М.: БИНОМ. Лаборатория знаний, 2008. — С. 406, 428—430.
- Некрасов Б. В. Основы общей химии. Т. 1. — М.: Химия, 1973. — С. 425.
Примечания
- ↑ Кислота азотноватистая - Справочник химика 21. chem21.info. Дата обращения: 24 марта 2025.