Нитрамид
| Нитрамид | |
|---|---|
  | |
| Общие | |
| Хим. формула | H2N2O2 |
| Рац. формула | NH2NO2 |
| Внешний вид | Бесцветные прозрачные кристаллы |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 62,03 г/моль |
| Плотность | 1,783 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 75 °С |
| • разложения | 95 °С |
| Энтальпия | |
| • образования | 298 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты | 6,5 |
| Классификация | |
| Рег. номер CAS | 7782-94-7 |
| PubChem | 24534 |
| SMILES | |
| InChI | |
| ChEBI | 29273 |
| ChemSpider | 22941 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
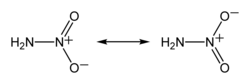
Нитрамид — химическое соединение с молекулярной формулой NH2NO2. Органические производные нитрамида называются нитраминами. Является неорганическим изомером азотноватистой кислоты. Нитрамид можно рассматривать как азотный аналог азотной кислоты (HO−NO2), в котором гидроксильная группа −OH заменена аминогруппой −NH2.
История
Впервые нитрамид был получен Фридрихом Тиле и Генрихом Лохманом в 1894 из уретана. С момента его получения учёные работают над изучением его свойств[1]. Позже, его свойства были подробнее изучены Алексом Ламбертоном в 1951[2].
Получение
Нитрирование аммиака при пониженных температурах приводит к образованию нитрамида и солей аммония.
Другой метод основан на реакции солей аминосульфоновой кислоты и азотной кислоты.
Реакция требует соблюдения температурного режима, в противном случае нитрамид разложится со вспышкой.
К образованию нитрамида приводит гидролиз динитромочевины:
Физические свойства
Нитрамид представляет собой бесцветные пластинчатые кристаллы с характерным блеском. Хорошо растворим в воде, спирте, эфирах и ацетоне. Плохо растворим в хлороформе, бензине и гексане.
Вещество очень чувствительно к механическому воздействию, но термически достаточно устойчиво. Температура разложения 95 °С. Соединение достаточно нестабильное, как и все его производные[1].
Химические свойства
Нитрамид является слабой одноосновной кислотой. Взаимодействует с щелочными металлами. Однако, все щелочные соли существуют не более минуты, быстро разлагаясь. Это связано с нестабильностью аниона HN2O2-.
Разлагается при нагревании до 80-95 °С с образованием закиси азота:
Нитрамид разлагается со вспышкой при взаимодействии с аммиаком. Аммонивую соль нитрамида можно получить, смешав его с аммиаком в эфире. Она может существовать только в растворе; быстро разлагается на воздухе.
Наиболее стабильной является соль ртути HgNNO2. Она разлагается продолжительное время.
По отношению к органическими веществам, нитрамид проявляет свойства нитрирующего агента. Ниже приведена реакция с мочевиной, приводящая к образованию нитромочевины:
Данную реакцию следует проводить при температуре 0-5 °С так как нитрамид способен взаимодействовать с серной кислотой, образуя смесь азотосодержащих продуктов.
Нитрамид взаимодействует с альдегидами. Наиболее рациональными являются реакции с альдегидами, имеющими не более 5 атомов углерода. Производные крупных альдегидов будут содержать слишком большие молекулы, что приведёт к разложению продуктов.
Присоединением формальдегида к нитрамиду получают бис(гидроксиметил)нитрамин.
Применив катализатор, можно получить метилендинитрамин. Реакцию проводят в этилацетате. Условное уравнение реакции выглядит следующим образом:
Вступает в реакцию алкилирования с диазометаном, образуя диметилнитрамин:
При взаимодействии нитрамида с сульфоксидами в присутствии уксусного ангидрида образуются нитроимиды сульфония. Например при реакции с диметилсульфоксидом образуется нитроимид диметилсульфония: [1]
Применение
Основное применение нитрамид имеет в качестве реагента в химической промышленности. Из него синтезируют азотсодержащие соединения[1].