Болезнь Вильсона — Коновалова
| Болезнь Вильсона | |
|---|---|
 Структура белка ATP7B, в гене которого у больных обнаруживаются мутации | |
| МКБ-11 | 5C64.00 |
| МКБ-10 | E83.0 |
| МКБ-10-КМ | E83.01 и E83.0 |
| МКБ-9 | 275.1 |
| OMIM | 277900 |
| DiseasesDB | 14152 |
| MedlinePlus | 000785 |
| eMedicine | med/2413 neuro/570 ped/2441 |
| MeSH | D006527 |
Болезнь Вильсона — Вестфаля — Коновалова (Гепатоцеребральная дистрофия, гепатолентикулярная дегенерация, болезнь Вестфаля — Вильсона) — врождённое нарушение метаболизма меди, приводящее к тяжелейшим поражениям центральной нервной системы и внутренних органов. Диагностируется у 5-10 % больных циррозом печени дошкольного и школьного возраста. Заболевание передаётся по аутосомнорецессивному типу. Ген ATP7B, мутации которого вызывают заболевание, расположен на 13-й хромосоме (участок 13q14-q21).
История
Английский невролог Сэмюель Вильсон (англ. S. Wilson — более нормативная передача У́илсон) (1878—1937) в 1912 году описал типичные для гепато-церебральной дистонии изменения в головном мозгу, установил постоянное наличие цирроза печени и дал описание клиники нового заболевания, названного им прогрессивной лентикулярной дегенерацией (лат. lenticularis чечевицеобразный).
В качестве основных симптомов заболевания были отмечены разнообразные непроизвольные движения конечностей и туловища, мышечная ригидность, приводящая к скованности, дисфагия и дизартрия, аффективные вспышки, иногда психические расстройства, но признаки поражения пирамидных путей отсутствовали. Ещё раньше К. Вестфалем (1883) и А. Штрюмпелем (1898) было описано заболевание, которое по клиническому сходству с рассеянным склерозом получило название «псевдосклероз». Заболевание характеризовалось распространёнными, размашистыми, ритмичными непроизвольными движениями, повышением мышечного тонуса, амимией, дизартрией и выраженными психическими нарушениями вплоть до такого расстройства интеллекта, как слабоумие.
В дальнейшем оказалось, что прогрессивная лентикулярная дегенерация и псевдосклероз являются разными формами одного и того же заболевания, которое Галль (1921) назвал гепатолентикулярной дегенерацией. Однако изменения в мозгу при нём никогда не ограничиваются лентикулярными ядрами и нередко бывают даже сильнее выражены в других отделах мозга.
В 1960 году советский невропатолог Н. В. Коновалов предложил название «гепатоцеребральная дистрофия», значительно расширил представления о патофизиологии, патогенезе и клинике этой болезни и выделил 4 формы поражения нервной системы и одну абдоминальную.[1]
Эпидемиология
Встречается в среднем в популяции с частотой 3:100000. Распространённость выше среди народностей, где распространён близкородственный брак. Болеют в равной степени как мужчины, так и женщины , средний возраст дебюта 11-25 лет. Для проявления заболевания имеют значение экзогенные воздействия, поражающие печень — интоксикация и инфекция.
Генетика
Ген, мутации в котором приводят к болезни Вильсона — Коновалова (ATP7B), расположен в длинном плече 13-й хромосомы (13q14.3). Ген кодирует P-тип АТФазы, которая транспортирует медь в жёлчь и включает её в церулоплазмин[2]. В 10 % случаев мутация не обнаруживается[3].
Хотя описано почти 300 мутаций ATP7B, в большинстве популяций болезнь Вильсона возникает в результате небольшого количества мутаций, специфичных для этих популяций. Например, для западных популяций мутация H1069Q (замена гистидина на глутамин в позиции 1069 белка) присутствует в 37-63 % случаев заболевания, в то время как в Китае эта мутация очень редка и R778L (замена аргинина на лейцин в позиции 778) встречается чаще. Относительно мало известно о влиянии мутаций на течение заболевания, хотя по данным некоторых исследований мутация H1069Q предполагает более позднее начало неврологических симптомов[2][4].
Нормальные вариации в гене PRNP могут изменить течение болезни, увеличивая возраст появления заболевания и влияя на тип симптомов, которые развиваются. Этот ген кодирует прионный белок, который активен в головном мозгу и других тканях, а также, как полагают, участвует в транспорте меди[5].
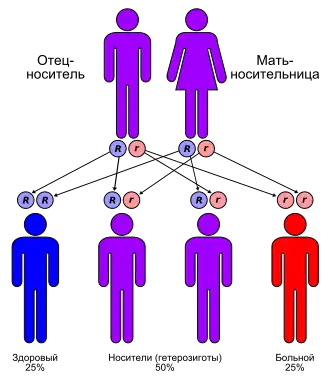
У заболевания аутосомнорецессивный тип наследования. То есть больной должен получить дефектный ген от обоих родителей (см. на рисунке). Люди только с одним мутантным геном (гетерозиготы) называются носителями. У них могут возникать слабовыраженные нарушения метаболизма меди[6].
Патогенез
Медь выполняет множество функций в организме. В основном она выступает в качестве кофактора для некоторых ферментов, таких как церулоплазмин, цитохром с-оксидаза, дофамин бета гидроксилаза, супероксиддисмутаза и тирозиназа[4].
Медь всасывается из желудочнокишечного тракта. Транспортный белок на клетках тонкой кишки CMT1 (англ. Copper Membrane Transporter 1) перемещает медь внутрь клеток. Часть меди связывается с металлотионеином, а другая — перемещается в сеть Гольджи с помощью транспортного белка ATOX1. В аппарате Гольджи в ответ на повышение концентрации меди фермент ATP7A (англ. Copper-transporting ATPase 1) высвобождает этот элемент через воротную вену в печень. В печёночных клетках белок ATP7B связывает медь с церулоплазмином и высвобождает его в кровь, а также удаляет избыток меди с выделяющейся жёлчью. Обе функции ATP7B нарушены при болезни Вильсона. Медь накапливается в ткани печени; церулоплазмин продолжает выделяться, но с недостатком меди (апоцерулоплазмин) и быстро разрушается в кровотоке[4].
Когда меди в печени становится больше, чем белков её связывающих, происходит их окислительное повреждение за счёт реакции Фентона. Это приводит к воспалению печени, её фиброзу и в итоге к циррозу. Также из печени в кровоток выделяется медь, которая не связана с церулоплазмином. Эта свободная медь оседает по всему организму, особенно в почках, глазах и головном мозге.
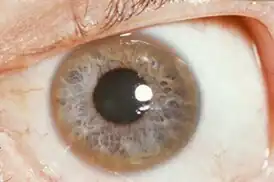
Основную роль в патогенезе играет нарушение обмена меди, её накопление в нервной (особенно поражены базальные ганглии), почечной, печёночной ткани и роговице, а также токсическое повреждение медью данных органов. Нарушение метаболизма выражается в нарушении синтеза и снижении в крови концентрации церулоплазмина. Церулоплазмин участвует в процессе выведения меди из организма. В печени формируется крупноузловой или смешаный цирроз. В почках в первую очередь страдают проксимальные канальцы. В головном мозгу поражаются в большей степени базальные ганглии, зубчатое ядро мозжечка и черная субстанция. Отложение меди в десцеметовой мембране глаза приводит к формированию кольца Кайзера-Флейшера.
Патологическая анатомия
В головном мозгу при гепатоцеребральной дистрофии размягчается чечевицеобразное ядро, особенно скорлупа, с образованием мелких кист. Поражаются и другие образования: хвостатое ядро, глубокие слои коры, мозжечок, в частности зубчатые ядра, подбугорные ядра; в остальных отделах головного мозга изменения выражены меньше.
Все изменения делятся на ангиотоксические и цитотоксические. Первые выражаются в атонии сосудов, особенно мелких, и изменении их стенок. В результате возникают стазы, распространённый периваскулярный отек с аноксией нервной ткани и её гибелью; часты геморрагии и следы их в виде скоплений гемосидерина.
Цитотоксический компонент заключается в распространённых дистрофических изменениях макроглии нервных клеток, часто заканчивающихся их гибелью. Характерно появление глии Альцгеймера, которая образуется из обычных астроцитов. Нередко встречаются изменённые нервные клетки, очень похожие на глию Альцгеймера; сходные клетки обнаруживаются также в печени и почках. В основе этих клеточных изменений лежит один и тот же фактор — однотипное нарушение клеточного обмена, вероятно, обмена нуклеиновых кислот.
Чем позднее начинается заболевание, тем медленнее оно протекает, тем более диффузны изменения в головном мозгу и тем более цитотоксический компонент преобладает над ангиотоксическим. Печень вследствие атрофического цирроза уменьшена и бугристая; участки нормальной ткани чередуются с участками некротическими, дегенерирующими и с островками регенерации; обильное новообразование сосудов приводит к появлению анастомозов между ветвями воротной и нижней полой вены.
Клиническая картина и течение
Гепато-церебральная дистрофия начинается в детском или молодом возрасте и имеет хроническое прогрессирующее течение. Во многих случаях появлению симптомов поражения нервной системы предшествуют висцеральные расстройства в виде нарушения деятельности печени и желудочно-кишечных расстройств (желтуха, боли в правом подреберье, диспептические явления). Порой развивается выраженный гепатолиенальный синдром. Со стороны нервной системы на первый план выступают экстрапирамидные симптомы в виде мышечной ригидности, гиперкинезов и расстройств психики. Пирамидные симптомы могут быть, но чаще отсутствуют. Чувствительность обычно не нарушена.
Типичным симптомом болезни являются кольца Кайзера-Флейшера — отложения по периферии роговой оболочки содержащего медь зеленовато-бурого пигмента, более выраженные на поздних стадиях. Иногда отмечается желтовато-коричневая пигментация кожи туловища и лица. Часты геморрагические явления (кровоточивость дёсен, носовые кровотечения, положительная проба жгута), мраморность кожи, акроцианоз. Капилляроскопия обнаруживает атонию капилляров и застойность кровотока. Отмечаются суставные боли, профузные поты, остеопороз, ломкость костей. Патология печени клинически выявляется примерно у 30 % больных, а в ряде случаев она может быть обнаружена только функциональными пробами, например пробой с нагрузкой галактозой, пробой Квинка, пробой Бергмана-Эльботта, бромсульфофталеиновой пробой; количество билирубина в крови и уробилина в моче обычно увеличено; изменены осадочные реакции Таката-Ара и Грея, обычны лейкопения, тромбоцитопения, гипохромная анемия.
Различают 5 форм гепато-церебральной дистрофии:[уточнить]
- Брюшная форма — тяжёлое поражение печени, приводящее к смерти раньше появления симптомов со стороны нервной системы; заболевают дети. Её продолжительность от нескольких месяцев до 3-5 лет.
- Ригидноаритмогиперкинетическая, или ранняя форма — отличается быстрым течением; начинается также в детском возрасте. В клинической картине преобладают мышечная ригидность, приводящая к контрактурам, бедность и замедленность движений, хореоатетоидные или торсионные насильственные движения. Характерны дизартрия и дисфагия, судорожный смех и плач, аффективные расстройства и умеренное снижение интеллекта.
- Дрожательноригидная форма встречается чаще других; начинается в юношеском возрасте, течёт медленнее, порой с ремиссиями и внезапными ухудшениями, сопровождающимися субфебрильной температурой; характеризуется одновременным развитием тяжёлой ригидности и дрожания, дрожание очень ритмичное (2-8 дрожаний в секунду), резко усиливается при статическом напряжении мышц, движениях и волнении, в покое и во сне исчезает. Иногда обнаруживаются атетоидные хореоформные насильственные движения; наблюдаются также дисфагия и дизартрия.
- Дрожательная форма начинается в возрасте 20-30 лет, течёт довольно медленно(10-15 лет и больше); дрожание резко преобладает, ригидность появляется лишь в конце болезни, а порой наблюдается гипотония мышц; отмечается амимия, медленная монотонная речь, тяжёлые изменения психики, часты аффективные вспышки. Наблюдаются эпилептиформные припадки.
- Экстрапирамиднокорковая форма встречается реже других форм. Типичные для гепато-церебральной дистрофии нарушения в дальнейшем осложняются апоплектиформно развивающимися пирамидными парезами, эпилептиформными припадками и тяжёлым слабоумием (обнаруживаются обширные размягчения в коре больших полушарий).
Наибольшая летальность (50 %) отмечается при печёночной форме с массивным некрозом и гемолизом у детей до 6 лет. Смерть больных от неврологических нарушений при отсутствии лечения наступает через 5-14 лет. Основная причина при этом интеркуррентные заболевания или желудочно-кишечные кровотечения, портальная гипертензия.
Диагностика
Основой диагностики является картина болезни. Диагноз заболевания подтверждается:
- Наличием кольца Кайзера-Флейшера или его «обломков».
- Содержание «общей» меди в сыворотке крови при болезни Вильсона-Коновалова обычно снижено менее чем на 12 мкг/дл, однако в редких случаях может быть и нормальным.[1]
- Снижение концентрации церулоплазмина ниже 20 мг на 100 мл[уточнить]
- Повышение экскреции меди с мочой более 100 мкг в сутки[уточнить]
Для диагностики используют:
- осмотр с помощью щелевой лампы (зелёное кольцо Кайзера-Флейшера на роговице у лимба)
- определение уровня церулоплазмина (типично снижение менее 1 мкмоль/л)[уточнить]
- определение уровня меди в сыворотке крови (снижение менее 9,4 мкмоль/л)[уточнить]
- определение меди в суточной моче (повышение более 1,6 мкмоль или 50 мкг в сутки)
- молекулярно-генетическое исследование мутаций в гене ATP7B.
Лечение
- Диета № 5 — с ограничением меди до 1 мг в сутки — исключение шоколада, орехов, сухофруктов, раков, печени, цельной пшеницы.
- Препаратом выбора является купренил (пеницилламин), который эффективен в 90 % случаев. Д-пеницилламин или унитиол.
- Унитиол
- Витамин B6
- Триентин
Патогенетическое лечение направлено на выведение меди из организма. Для этого применяются комплексообразующие соединения: тиолы, пеницилламин. Лечение пеницилламином сопровождается заметным улучшением состояния больных или даже приводит к полной ликвидации симптомов.
Трансплантация печени
Трансплантация печени является эффективным средством для лечения болезни Вильсона-Коновалова, однако используют ее только в отдельных случаях, что связано с риском данной процедуры. Как правило, ее проводят людям с острой печеночной недостаточностью, не поддающимся медикаментозному лечению или людям с развитой хронической печеночной недостаточностью.
В культуре
- Данное заболевание выявляется у одной из пациенток в финале 6 серии 1 сезона и у пациентки в 12 серии 6 сезона сериала «Доктор Хаус».
- Заболевание подтверждается у пациентки в 1-м сезоне 6 серии «Доктор Рихтер».
- Данное заболевание подтверждается у пациентки (заключенной) в сериале «Saving hope» во 2 сезоне, в 5 серии.
- Упоминается в 11-й серии 7-го сезона сериала «Клиника». Вся серия построена вокруг обнаружения данной болезни, например, обнаружения «золотого кольца» на зрачке пациента.
- Упоминается в романе Ивана Ефремова «Лезвие Бритвы». Диагноз не подтвердился.
- Главная героиня японского фильма 2019 г. «Первая любовь в потерянном времени» больна болезнью Вильсона.
Примечания
- 1 2 Ерёмина Е. Ю. Болезнь Вильсона-Коновалова : [арх. 2 декабря 2021] // Вестник современной клинической медицины.. — 2011. — Т. 4, № 1.
- 1 2 Ala A., Walker A.P., Ashkan K., Dooley J.S., Schilsky M.L. Wilson's disease (англ.) // The Lancet. — Elsevier, 2007. — Vol. 369, no. 9559. — P. 397—408. — doi:10.1016/S0140-6736(07)60196-2. — PMID 17276780.
- ↑ Merle U., Schaefer M., Ferenci P., Stremmel W. Clinical presentation, diagnosis and long-term outcome of Wilson's disease: a cohort study (англ.) // Gut : journal. — 2007. — Vol. 56, no. 1. — P. 115—120. — doi:10.1136/gut.2005.087262. — PMID 16709660. — PMC 1856673. Архивировано 4 мая 2008 года.
- 1 2 3 de Bie P., Muller P., Wijmenga C., Klomp L.W. Molecular pathogenesis of Wilson and Menkes disease: correlation of mutations with molecular defects and disease phenotypes (англ.) // Journal of Medical Genetics : journal. — 2007. — November (vol. 44, no. 11). — P. 673—688. — doi:10.1136/jmg.2007.052746. — PMID 17717039. — PMC 2752173. Архивировано 30 января 2008 года.
- ↑ Grubenbecher S., Stüve O., Hefter H., Korth C. Prion protein gene codon 129 modulates clinical course of neurological Wilson disease (англ.) // NeuroReport : journal. — 2006. — Vol. 17, no. 5. — P. 549—552. — doi:10.1097/01.wnr.0000209006.48105.90. — PMID 16543824.
- ↑ Roberts E.A., Schilsky M.L. A practice guideline on Wilson disease (англ.) // Hepatology. — Wiley-Liss, 2003. — Vol. 37, no. 6. — P. 1475—1492. — doi:10.1053/jhep.2003.50252. — PMID 12774027. (недоступная ссылка)
Литература
- Подымова С. Д. Болезни печени: Руководство для врачей. — М.: Медицина, 1993.
- Шабалов Н. П. Детские болезни. — СПб., 2000. — С. 550.
- Пайков В. Л., Хацкель С. Б., Эрман Л. В. Гастроэнтерология детского возраста. — СПб., 1998. — С. 198—203.
- Иванова-Смоленская И. А. Болезнь Вильсона-Коновалова // Нервы. — 2006. — № 4.