Каспазы
| Доменная структура каспазы | |
|---|---|
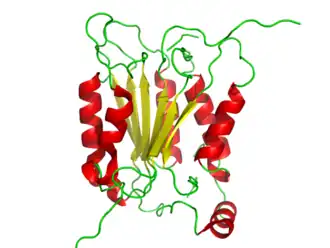 Структура каспазы 1 (CASP1), первоначально называемая интерлейкин-1 бета-конвертирующим ферментом (ICE), является первой человеческой каспазой, которая была идентифицирована[1]. | |
| Идентификаторы | |
| Символ | Peptidase_C14 |
| Pfam | PF00656 |
| Pfam clan | CL0093 |
| InterPro | IPR002398 |
| PROSITE | PS50208 |
| MEROPS | C14 |
| SCOP | 1ice |
| SUPERFAMILY | 1ice |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Каспазы (англ. caspase; сокр. от англ. cysteine-dependent aspartate specific protease) — протеолитические ферменты, относящихся к семейству цистеиновых протеаз (КФ 3.4.22), расщепляющих белки исключительно после аспартата. Каспазы играют важную роль в процессах апоптоза, некроза и воспалительных процессах.
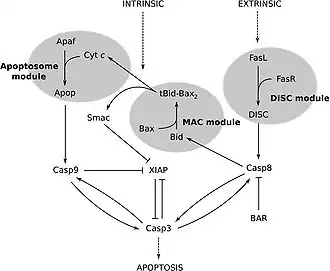
Каспазы подразделяют на инициаторные, воспалительные и эффекторные (экзекуторные). Все каспазы первоначально синтезируются в неактивной форме, и активируются по мере необходимости инициаторными каспазами отсечением небольшого участка. Инициаторные каспазы активируются более сложным образом — специальными белковыми комплексами: апоптосомами, PIDD-осомами, DISC. По состоянию на 2009 г. у человека имеется 11 или 12 подтверждённых каспаз и 10 у мышей[note 1], выполняющих разнообразные клеточные функции.
Роль этих ферментов в запрограммированной гибели клеток была впервые определена в 1993 году, а их функции в апоптозе хорошо охарактеризованы. Такая форма запрограммированной гибели клеток, широко распространённая в процессе развития и в течение всей жизни служит для поддержания клеточного гомеостаза. Активация каспаз обеспечивает контролируемое деструкции клеточных компонентов, что приводит к гибели клеток с минимальным воздействием на окружающие ткани (без их вовлечения в процесс)[3].
Каспазы играют другие определённые роли в запрограммированной гибели клеток, таких как пироптоз и некроптоз. Данные формы гибели клеток важны для защиты организма от сигналов клеточного стресса и атаки патогенами. Каспазы также играют роль в воспалении, посредством чего они непосредственно усиливают процессинг провоспалительных цитокинов, таких как про-IL1β. Это сигнальные молекулы, которые позволяют рекрутировать иммунные клетки, атакующих инфицированные клетки или ткани. Существуют и другие идентифицированные роли каспаз, такие как пролиферация клеток, подавление опухолей, дифференцировка клеток, развитие нервной системы, направление аксонов и старение[4].
Дефицит каспазы был идентифицирован как одна из причин развития новообразований. Рост опухоли может происходить за счёт комбинации факторов, в том числе мутации в генах клеточного цикла, которые снимают ограничения роста клеток, в сочетании с мутациями в апоптопных белках, таких как каспазы, которые активируются и вызывают гибель аномально растущих клеток[5]. И наоборот, чрезмерная активация некоторых каспаз, например, каспазы 3, может привести к чрезмерной запрограммированной гибели клеток. Такое являение наблюдается при некоторых нейродегенеративных заболеваниях, когда происходит необратимая потеря нервных клеток, примером служит болезнь Альцгеймера[5]. Каспазы, связанные с процессингом воспалительных сигналов, также вовлечены в протекание многих заболеваний. Недостаточная активация данных каспаз может повысить восприимчивость организма к инфекции, так как соответствующий иммунный ответ может не произойти[5]. Неотъемлемая роль каспаз в гибели клеток и протекании заболеваний привела к исследованию использования ферментов в качестве мишеней для лекарств (таргетная терапия). Например, воспалительная каспаза 1 участвует в патогенезе аутоиммунных заболеваний; препараты, блокирующие активацию каспазы 1, использовались для улучшения здоровья пациентов. Кроме того, учёные использовали каспазы в качестве терапии злокачественных опухолей для уничтожения нежелательных клеток в бластомогенных тканях[6].
Функциональная классификация каспаз
Большинство каспаз играют роль в запрограммированной гибели клеток. Они обобщены в таблице ниже. Ферменты подразделяются на три типа: инициаторные, эффекторные или экзекуторные и воспалительные[7].
| Запрограммированная смерть клеток | Тип каспазы | Фермент | Организм, в котором обнаружены каспазы |
|---|---|---|---|
| Апоптоз | Инициаторные | Каспаза 2 | человек и мышь |
| Каспаза 8 | человек и мышь | ||
| Каспаза 9 | человек и мышь | ||
| Каспаза 10 | только человек[8] | ||
| Экзекуторные (эффекторные) | Каспаза 3 | человек и мышь | |
| Каспаза 6 | человек и мышь | ||
| Каспаза 7 | человек и мышь | ||
| Пироптоз | Воспалительные | Каспаза 1 | человек и мышь |
| Каспаза 4 | человек[note 2] | ||
| Каспаза 5 | человек[note 2] | ||
| Каспаза 11 | мышь[note 2] | ||
| Каспаза 12 | мышь и некоторые люди[note 1] | ||
| Каспаза 13 | только коровы[10] | ||
| Другая роль | Другие | Каспаза 14 | человек и мышь |
Обратите внимание, что в дополнение к апоптозу каспаза 8 также необходима для ингибирования другой формы запрограммированной гибели клеток, называемой некроптозом[11]. Каспаза 14 играет роль в дифференцировке кератиноцитов эпителиальных клеток и может образовывать эпидермальный барьер, который защищает от дегидратации (обезвоживания) и ультрафиолетового излучения[12].
Активация каспаз
Каспазы синтезируются как неактивные зимогены (прокаспазы), которые активируются только после соответствующего стимула. Данный посттрансляционный уровень контроля позволяет быстро и жестко регулировать фермент.
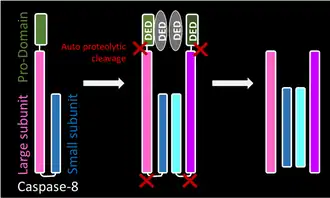
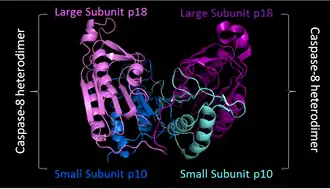
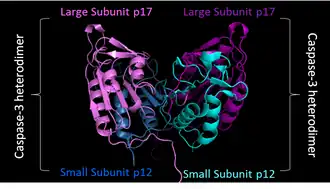
Активация включает димеризацию и часто олигомеризацию прокаспаз с последующим расщеплением на две субъединицы различного размера — большую и малую. Большая и маленькая субъединицы связываются друг с другом, образуя активную гетеродимерную каспазу. Активный фермент в природе часто существует в качестве гетеротетрамера, где димер прокаспазы расщепляется вместе с образованием гетеротетрамера[13].
Димеризация
Активация инициаторных каспаз и воспалительных каспаз инициируется димеризацией, посредством связывания с адапторными белками, имеющих мотивы межбелкового взаимодействия, так называемые фолды смерти. Фолды смерти расположены в структурном домене каспаз, известном как про-домен, его больше в тех каспазах, которые содержат фолды смерти, чем в не содержащих каспазах. Про-домен внутренних исходных инициаторных каспаз и воспалительных каспаз содержит один смертельный фолд, известный как «домен активации и рекрутирования каспазы» (сокр. CARD), тогда как про-домен внешних инициаторных каспаз содержит два фолда смерти, известных как «домены эффектора смерти» (сокр. DED)[14][15].
Часто, во время активации каспаз образуются мультипротеиновые комплексы[13]. Некоторые, активирующиеся мультипротеиновые комплексы включают в себя:
- «Сигнальный комплекс, индуцирующий смерть» (сокр. DISC), образуется во время внешней (рецептор-зависимой) стадии апоптоза
- Апоптосому во время собственного апоптоза
- Инфламмасому во время пироптоза.
Расщепление
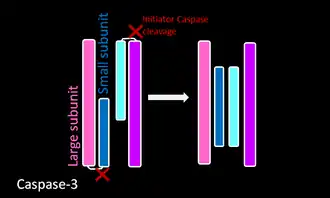
После соответствующего процесса димеризации каспазы расщепляются в междоменных линкерных областях, образуя большую и маленькую субъединицу. Такое расщепление позволяет петлям активного сайта принимать конформацию, благоприятную для ферментативной активности[16]. Расщепление инициаторных и эффекторных (экзекуторных) каспаз происходит различными способами, описанными в таблице ниже.
- Инициаторные каспазы подвержены автоматическому протеолизу, тогда как экзекуторные каспазы расщепляются инициаторными каспазами. Такая иерархия позволяет усиливать цепную реакцию или каскад для деградации клеточных компонентов во время контролируемой гибели клеток.
| Инициаторная каспаза
Каспаза 8 |
 |
 |
| Экзекуторная каспаза
Каспаза Каспазы 3 |
 |
 |
Некоторые роли, исполняемые каспазами
В апоптозе
Апоптоз является формой запрограммированной гибели клеток, когда клетка претерпевает морфологические изменения, которые минимизируют своё влияние на окружающие клетки, чтобы избежать индукции иммунного ответа. Клетка сжимается и конденсируется — цитоскелет разрушается, ядерная оболочка разбирается и происходит фрагментация ДНК. Это приводит к тому, что клетки образуют замкнутые тела, называемые «пузырьками», чтобы избежать высвобождения клеточных компонентов во внеклеточную среду. Кроме того, изменяется содержание фосфолипидов в клеточной мембране, что делает умирающую клетку более восприимчивой к фагоцитарной атаке и утилизации[18].
.svg.png)
Апоптопические каспазы подразделяются на:
- Инициаторные каспазы (каспаза 2, каспаза 8, каспаза 9, каспаза 10)
- Эффекторные (экзекуторные) каспазы (каспаза 3, каспаза 6 и каспаза 7)
Как только происходит активация инициаторных каспаз, запускается цепная реакция, приводящая к активации нескольких других эффекторных каспаз. Экзекуторные каспазы разрушают более 600 клеточных компонентов[19], чтобы вызвать морфологические изменения при апоптозе.
Примеры каспазных каскадов, происходящих во время апоптоза:
- Внутренний (митохондриальный) сигнальный путь апоптоза: во время клеточного стресса митохондриальный цитохром c высвобождается в цитозоль. Эта молекула связывает адаптерный белок (APAF-1), который рекрутирует инициаторную каспазу 9 (посредством взаимодействия CARD-CARD). Это приводит к образованию каспазы, активирующей мультипротеиновый комплекс, называемый апоптосомой. После активации инициаторных каспаз, таких как каспаза 9, происходит расщепление и активация других каспаз-эффекторов. Это приводит к деградации клеточных компонентов при апоптозе.
- Внешний сигнальный путь апоптоза: Каспазный каскад также активируется внеклеточными лигандами посредством рецепторов смерти, расположенных на клеточной поверхности. Это достигается путём формирования полипротеинового сигнального комплекса смерти (DISC), который рекрутирует и активирует прокаспазу. Например, лиганд FasL связывает рецептор FasR на внеклеточной поверхности рецептора; связывание активирует домены смерти в цитоплазматическом хвосте рецептора. Адаптерный белок FADD будет рекрутировать (посредством взаимодействия домена смерти и домена смерти) прокаспазу 8 через домен DED. Данные белки FasR, FADD и прокаспаза 8 образуют «сигнальный комплекс, индуцирующий смерть» (DISC), в котором активируется каспаза 8. Это может привести либо к нисходящей активации внутреннего пути путём индукции митохондриального стресса, либо к прямой активации каспаз-экзекуторов (каспаза 3, каспаза 6 и каспаза 7), предназначенных для разрушения клеточных компонентов, как показано внизу на обобщённой схеме[20].
.svg.png)
В пироптозе
Пироптоз является одной из форм запрограммированной гибели клеток, которая по своей природе вызывает иммунный ответ. Он морфологически отличается от других типов гибели клеток — клетки набухают, разрываются и выделяют провоспалительное клеточное содержимое. Это происходит в ответ на ряд раздражителей, включая микробные инфекции, а также сердечные приступы (например, происходящие при инфаркте миокарда)[21]. Каспаза 1, каспаза 4 и каспаза 5 у людей и каспаза 1 и каспаза 11 у мышей играют важную роль в индукции гибели клеток при пироптозе. Данный процесс ограничивает жизнь и время пролиферации внутриклеточных и внеклеточных патогенов.
Участие каспазы 1 в пироптозе
Активация каспазы 1 опосредована репертуаром белков, что позволяет выявлять целый ряд патогенных лигандов. Некоторыми медиаторами активации каспазы 1 являются: NOD-подобные рецепторы (NLRs), AIM2-подобные рецепторы (ALRs), Пирин и IFI16[22]. Данные белки позволяют активировать каспазу 1 путём образования активирующего мультипротеинового комплекса, называемого инфламмасомой.
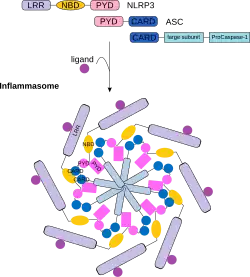
Например, NOD-подобный обогащённый лейцином повтор, NLRP3 чувствителен к оттоку ионов калия из клетки (K+). Этот клеточный ионный дисбаланс приводит к олигомеризации молекул NLRP3 с образованием мультипротеинового комплекса, называемого NLRP3-инфламмасомой. Прокаспаза 1 приводится в непосредственную близость с другой молекулой прокаспазы, происходит дальнейший процесс димеризации и аутопротеолитическое расщеплению[22].
Некоторые патогенные сигналы, которые приводят к пироптозу, вызванный активацией каспазой 1, перечислены ниже:
- ДНК в цитозоле клетки связывается с AIM2-подобными рецепторами, вызывающими пироптоз
- Аппарат бактериальной системы секреции III типа (встречается у бактерий Yersinia, Salmonella и Shigella[23]) связывается с NOD-подобным богатым лейцином повтором, называемым NAIP (NAIP1 у человека и NAIP4 у мышей).
Пироптоз, вызванный активацией каспазы 4 и каспазы 5 у людей и каспазы 11 у мышей
Эти каспазы обладают способностью вызывать прямой пироптоз, когда молекулы липополисахарида (LPS) (обнаруженные в клеточной стенке грамотрицательных бактерий) проникают и идентифицируются в цитоплазме клетки-хозяина. Например, каспаза 4 действует как рецептор и протеолитически активируется без необходимости в инфламмасоме или без активации каспазы 1[22].
Важнейшим нижестоящим субстратом для пироптопических каспаз является гасдермин D (GSDMD)[24].
Роль в воспалении
Воспаление представляет собой как защитную реакцию организма в результате негативного воздействия вредного раздражителя, таких как повреждение ткани или бактериальная инфекция и направленную на восстановление равновесного (нормального) гомеостатического состояния[19].
Каспаза 1, каспаза 4, каспаза 5 и каспаза 11 считаются воспалительными каспазами[7].
- Каспаза 1 является ключевой в активации провоспалительных цитокинов; они действуют как сигналы для иммунных клеток и создают благоприятную среду для рекрутирования иммунных клеток в месте повреждения. Поэтому каспаза 1 играет фундаментальную роль во врождённой иммунной системе. Фермент отвечает за процессинг цитокинов, таких как pro-ILβ и pro-IL18, а также за их секрецию (выделение)[22].
- Каспаза 4 и 5 у человека и каспаза 11 у мышей играют уникальную роль в качестве рецептора, благодаря чему они связываются с LPS, молекулой, которой богаты поверхности клеток грамотрицательных бактерий. Связывание может привести к процессингу и секреции цитокинов IL-1β и IL-18 путём активации каспазы 1; этот последующий эффект такой же, как описано выше. Это также приводит к секреции другого воспалительного цитокина, который не подвержен процессингу. Молекула цитокина называется про-IL1α. Также имеются данные о воспалительной каспазе, способствующей секреции цитокинов, осуществляемой каспазой 11; процесс происходит путём инактивации мембранного канала, который блокирует секрецию IL-1β[22].
- Каспазы могут также вызывать воспалительный ответ на транскрипционном уровне. Существуют доказательства того, что данный воспалительный ответ способствует транскрипции ядерного фактора-κB (NF-κB), транскрипционного фактора, который помогает транскрибировать воспалительные цитокины, такие как IFN, TNF, IL-6 и IL-8. Например, каспаза 1 активирует каспазу 7, которая в свою очередь расщепляет поли(АДФ-рибоза)-полимеразу — это активирует транскрипцию генов, контролируемых NF-κB[19].
Открытие каспаз
Роберт Хорвиц первоначально установил важность каспаз при апоптозе и обнаружил, что ген ced-3 необходим для гибели клеток, которая произошла во время развития нематоды C. elegans. Хорвиц и его коллега Джуниинг Юань обнаружили в 1993 году, что белок, кодируемый геном ced-3, представляет собой цистеиновую протеазу со свойствами, аналогичными ферменту, интерлейкин-1-бета превращающему у млекопитающих (ICE) (в настоящее время известный как каспаза 1). В то время ICE была единственной известной каспазой[25]. Впоследствии были идентифицированы каспазы других млекопитающих, в дополнение к каспазам, втречаемых в организмах, как, например у плодовой мухи Drosophila melanogaster.
Исследователи определились с номенклатурой каспаз в 1996 году. Во многих случаях конкретная каспаза была идентифицирована одновременно более чем одной лабораторией; каждая из которых тогда дали белкам различные наименования. Например, каспаза 3 была по-разному известна как CPP32, апопаин и Yama. Поэтому каспазы были пронумерованы в том порядке, в котором они были идентифицированы[26]. Поэтому ICE был переименован в каспазу 1. ICE был первой каспазой млекопитающих, которая была охарактеризована из-за её сходства с геном гибели нематод ced-3, но, по-видимому, основная роль этого фермента заключается в опосредовании воспаления, нежели в гибели клеток.
Эволюция
У животных апоптоз индуцируется каспазами, а у грибов и растений апоптоз индуцируется аргинин- и лизин-специфической каспазоподобной протеазой, называемой метакаспазой. Поиск гомологии выявил тесную гомологию между каспазами и каспазоподобными белками Reticulomyxa (одноклеточного организма). Филогенетическое исследование показывает, что расхождение последовательностей каспазы и метакаспазы происходило до расхождения эукариот[27].
См. также
Литература
- Обзор: Human caspases: activation, specificity, and regulation. Pop C, Salvesen GS. J Biol Chem. 2009 Aug 14;284(33):21777-81. Epub 2009 May 26. PMID 19473994
Ссылки
- ↑ Wilson K. P., Black J. A., Thomson J. A. et al. Structure and mechanism of interleukin-1 beta converting enzyme (англ.) // Nature : journal. — 1994. — July (vol. 370, no. 6487). — P. 270—275. — doi:10.1038/370270a0. — PMID 8035875.
- ↑ Saleh, Maya; Vaillancourt, John P; Graham, Rona K; Huyck, Matthew; Srinivasula, Srinivasa M; Alnemri, Emad S; Steinberg, Martin H; Nolan, Vikki; Baldwin, Clinton T; Hotchkiss, Richard S; Buchman, Timothy G; Zehnbauer, Barbara A; Hayden, Michael R; Farrer, Lindsay A; Roy, Sophie; Nicholson, Donald W. Differential modulation of endotoxin responsiveness by human caspase-12 polymorphisms (англ.) // Nature : journal. — 2004. — Vol. 429, no. 6987. — P. 75—9. — doi:10.1038/nature02451. — PMID 15129283.
- ↑ Rathore, S.; Datta, G.; Kaur, I.; Malhotra, P.; Mohmmed, A. Disruption of cellular homeostasis induces organelle stress and triggers apoptosis like cell-death pathways in malaria parasite (англ.) // Cell Death & Disease : journal. — 2015. — 2 July (vol. 6, no. 7). — P. e1803. — doi:10.1038/cddis.2015.142. — PMID 26136076. — PMC 4650714.
- ↑ Shalini, S.; Dorstyn, L.; Dawar, S.; Kumar, S. Old, new and emerging functions of caspases (англ.) // Cell Death & Differentiation : journal. — 2015. — 1 April (vol. 22, no. 4). — P. 526—539. — ISSN 1350-9047. — doi:10.1038/cdd.2014.216. — PMID 25526085. — PMC 4356345.
- 1 2 3 Goodsell, David S. The Molecular Perspective: Caspases (англ.) // The Oncologist : journal. — 2000. — 1 October (vol. 5, no. 5). — P. 435—436. — ISSN 1083-7159. — doi:10.1634/theoncologist.5-5-435. — PMID 11040280.
- ↑ McIlwain, David R.; Berger, Thorsten; Mak, Tak W. Caspase Functions in Cell Death and Disease (англ.) // Cold Spring Harbor Perspectives in Biology : journal. — 2013. — 1 April (vol. 5, no. 4). — P. a008656. — ISSN 1943-0264. — doi:10.1101/cshperspect.a008656. — PMID 23545416. — PMC 3683896.
- 1 2 Lorenzo; Galluzzi; López-Soto, Alejandro; Kumar, Sharad; Kroemer, Guido. Caspases Connect Cell-Death Signaling to Organismal Homeostasis (англ.) // Immunity : journal. — Cell Press, 2016. — 16 February (vol. 44, no. 2). — P. 221—231. — ISSN 1074-7613. — doi:10.1016/j.immuni.2016.01.020. — PMID 26885855.
- ↑ Jänicke, Reiner U.; Sohn, Dennis; Totzke, Gudrun; Schulze-Osthoff, Klaus. Caspase-10 in Mouse or Not? (англ.) // Science. — 2006. — June (vol. 312, no. 5782). — P. 1874. — doi:10.1126/science.312.5782.1874a. — PMID 16809511.
- ↑ Stowe, Irma; Lee, Bettina; Kayagaki, Nobuhiko. Caspase-11: arming the guards against bacterial infection (англ.) // Immunological Reviews : journal. — 2015. — Vol. 265, no. 1. — P. 75—84. — doi:10.1111/imr.12292. — PMID 25879285.
- ↑ Koenig, Ulrich; Eckhart, Leopold; Tschachler, Erwin. Evidence That Caspase-13 Is Not a Human but a Bovine Gene (англ.) // Biochemical and Biophysical Research Communications : journal. — 2001. — Vol. 285, no. 5. — P. 1150—1154. — doi:10.1006/bbrc.2001.5315. — PMID 11478774.
- ↑ Vanden Berghe T., Linkermann A., Jouan-Lanhouet S., Walczak H., Vandenabeele P. Regulated necrosis: the expanding network of non-apoptotic cell death pathways (англ.) // Nature Reviews. Molecular Cell Biology : journal. — 2014. — February (vol. 15, no. 2). — P. 135—147. — doi:10.1038/nrm3737. — PMID 24452471.
- ↑ Denecker, Geertrui; Ovaere, Petra; Vandenabeele, Peter; Declercq, Wim. Caspase-14 reveals its secrets (англ.) // The Journal of Cell Biology : journal. — 2008. — 11 February (vol. 180, no. 3). — P. 451—458. — ISSN 0021-9525. — doi:10.1083/jcb.200709098. — PMID 18250198. — PMC 2234247.
- 1 2 Shi, Yigong. Caspase Activation (англ.) // Cell : journal. — Cell Press, 2004. — 25 June (vol. 117, no. 7). — P. 855—858. — ISSN 0092-8674. — doi:10.1016/j.cell.2004.06.007. — PMID 15210107.
- ↑ Lahm, Armin; Paradisi, Andrea; Green, Douglas R; Melino, Gerry. Death fold domain interaction in apoptosis (англ.) // Cell Death and Differentiation : journal. — 2003. — Vol. 10, no. 1. — P. 10—2. — doi:10.1038/sj.cdd.4401203. — PMID 12655289.
- ↑ Kumar, S. Caspase function in programmed cell death (англ.) // Cell Death and Differentiation : journal. — 2006. — Vol. 14, no. 1. — P. 32—43. — doi:10.1038/sj.cdd.4402060. — PMID 17082813.
- ↑ Riedl, Stefan J.; Shi, Yigong. Molecular mechanisms of caspase regulation during apoptosis (англ.) // Nature Reviews Molecular Cell Biology : journal. — 2004. — November (vol. 5, no. 11). — P. 897—907. — doi:10.1038/nrm1496. — PMID 15520809.
- ↑ Lavrik, I.; Krueger, A.; Schmitz, I.; Baumann, S.; Weyd, H.; Krammer, P. H.; Kirchhoff, S. The active caspase-8 heterotetramer is formed at the CD95 DISC (англ.) // Cell Death & Differentiation : journal. — 2003. — 1 January (vol. 10, no. 1). — P. 144—145. — ISSN 1350-9047. — doi:10.1038/sj.cdd.4401156. — PMID 12655304.
- ↑ Elmore, Susan. Apoptosis: A Review of Programmed Cell Death (англ.) // Toxicologic Pathology : journal. — 2007. — 1 June (vol. 35, no. 4). — P. 495—516. — ISSN 0192-6233. — doi:10.1080/01926230701320337. — PMID 17562483. — PMC 2117903.
- 1 2 3 Sollberger, Gabriel; Strittmatter, Gerhard E.; Garstkiewicz, Martha; Sand, Jennifer; Beer, Hans-Dietmar. Caspase-1: The inflammasome and beyond (англ.) // Innate Immunity : journal. — 2014. — 1 February (vol. 20, no. 2). — P. 115—125. — ISSN 1753-4259. — doi:10.1177/1753425913484374. — PMID 23676582.
- ↑ Creagh, Emma M. Caspase crosstalk: integration of apoptotic and innate immune signalling pathways (англ.) // Trends in Immunology : journal. — Cell Press, 2014. — December (vol. 35, no. 12). — P. 631—640. — doi:10.1016/j.it.2014.10.004. — PMID 25457353.
- ↑ Bergsbaken, Tessa; Fink, Susan L.; Cookson, Brad T. Pyroptosis: host cell death and inflammation (англ.) // Nature Reviews Microbiology : journal. — 2009. — Vol. 7, no. 2. — P. 99—109. — doi:10.1038/nrmicro2070. — PMID 19148178. — PMC 2910423.
- 1 2 3 4 5 Eldridge, Matthew JG; Shenoy, Avinash R. Antimicrobial inflammasomes: unified signalling against diverse bacterial pathogens (англ.) // Current Opinion in Microbiology : journal. — Elsevier, 2015. — Vol. 23. — P. 32—41. — doi:10.1016/j.mib.2014.10.008. — PMID 25461570.
- ↑ Green E. R., Mecsas J. Bacterial Secretion Systems: An Overview. (англ.) // Microbiology Spectrum. — 2016. — February (vol. 4, no. 1). — doi:10.1128/microbiolspec.VMBF-0012-2015. — PMID 26999395.
- ↑ He, Wan-ting; Wan, Haoqiang; Hu, Lichen; Chen, Pengda; Wang, Xin; Huang, Zhe; Yang, Zhang-Hua; Zhong, Chuan-Qi; Han, Jiahuai. Gasdermin D is an executor of pyroptosis and required for interleukin-1β secretion (англ.) // Cell Research : journal. — 2015. — 1 December (vol. 25, no. 12). — P. 1285—1298. — ISSN 1001-0602. — doi:10.1038/cr.2015.139. — PMID 26611636. — PMC 4670995.
- ↑ Yuan, J. et al. The C. elegans cell death gene ced-3 encodes a protein similar to mammalian interleukin-1 beta-converting enzyme (англ.) // Cell : journal. — Cell Press, 1993. — Vol. 75, no. 4. — P. 641—652. — doi:10.1016/0092-8674(93)90485-9. — PMID 8242740.
- ↑ Alnemri ES; Emad S. et al. Human ICE/CED-3 Protease Nomenclature (англ.) // Cell. — Cell Press, 1996. — Vol. 87, no. 2. — P. 171. — doi:10.1016/S0092-8674(00)81334-3. — PMID 8861900. Архивировано 17 декабря 2012 года.
- ↑ Klim, Joanna; Gładki, Arkadiusz; Kucharczyk, Roza; Zielenkiewicz, Urszula; Kaczanowski, Szymon. Ancestral State Reconstruction of the Apoptosis Machinery in the Common Ancestor of Eukaryotes (англ.) // G3: Genes, Genomes, Genetics : journal. — 2018. — 27 April (vol. 8, no. 6). — P. 2121—2134. — ISSN 2160-1836. — doi:10.1534/g3.118.200295. — PMID 29703784. — PMC 5982838.
Внешние ссылки
Примечания
- 1 2 Functional CASP12 is only expressed in some individuals of African descent, while individuals of Asian or Caucasian descent express only a non-functional truncated form.[2]
- 1 2 3 CASP4 and CASP5 are considered to be the human orthologues of CASP11, which was found in mice and rats but not in humans.[9]