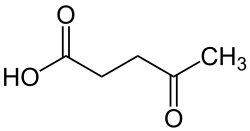
Левулиновая кислота
| Левулиновая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
4-оксопентановая кислота | ||
| Традиционные названия |
левулиновая кислота, 4-оксовалериановая кислота, β-ацетилпропионовая кислота, 3-ацетопропионовая кислота, γ-кетовалериановая кислота, |
||
| Хим. формула | C5H8O3 | ||
| Рац. формула | СН3СОСН2СН2СООН | ||
| Физические свойства | |||
| Состояние | твёрдое кристаллическое вещество белого цвета | ||
| Молярная масса | 116,1152 ± 0,0055 г/моль | ||
| Плотность | 1,1447 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 33-35 °C | ||
| • кипения | 245–246 °C | ||
| • вспышки | 137 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты |
4,64 (при 18 °С), 4,62 (при 25 °С) |
||
| Растворимость | |||
| • в воде | 67,5 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,439 | ||
| Классификация | |||
| Рег. номер CAS | 123-76-2 | ||
| PubChem | 11579 | ||
| Рег. номер EINECS | 204-649-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | OI1575000 | ||
| ChEBI | CHEBI:45630 | ||
| ChemSpider | 11091 | ||
| Безопасность | |||
| ЛД50 |
450 мг/кг (мыши,внутрибрюшинно), 1850 мг/кг (крысы, перорально), 5000 мг/кг (кролики, накожно) |
||
| Токсичность | Слаботоксична, раздражает кожу и слизистые оболочки, едкое вещество | ||
| Пиктограммы ECB |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Левулиновая кислота она же 4-оксопентановая кислота — одноосновная карбоновая кислота, первый простейший представитель γ-кетокислот.
Физико-химические свойства
Левулиновая кислота представляет собой твёрдое кристаллическое вещество белого цвета, растворимое в воде (растворимость повышается при нагревании), этаноле и эфире, кислота средней силы pKa = 4,62 (при 25 °С), довольно едкая, пары могут вызвать раздражение кожи и слизистых оболочек. Левулиновая кислота имеет все свойства карбоновой кислоты и кетона[1], и поэтому образует производные как по карбонильной, так и по карбоксильной группам. Соли левулиновой кислоты называются левулинатами.
При обезвоживании левулиновой кислоты образуется так называемый лактон анжелика[2].
Получение
Все практические методы получения левулиновой кислоты основаны на действии минеральных кислот на углеводы. Эту реакцию открыли Гроте и Толленс, получившие левулиновую кислоту нагреванием тростникового сахара с разбавленной серной кислотой. Лучший выход левулиновой кислоты достигается действием соляной кислоты на сахарозу при нагревании. Левулиновая кислота также может быть получена из крахмала, инулина и глюкозы действием соляной кислоты, а также из фурфурилового спирта или оксиметилфурфурола действием разбавленных минеральных кислот (серной или соляной).
Оксиметилфурфурол гидролизуется под действием серной кислоты на левулиновую и муравьиную кислоты.
Синтетически левулиновую кислоту получают конденсацией натрийацетоуксусного эфира с эфиром α-бромуксусной кислоты и гидролизом полученного при этом эфира ацетилянтарной кислоты с последующим декарбоксилированием[3].
Применение
Левулиновая кислота и её соли широко используются в фармацевтике (пролекарство) и в органическом синтезе, левулинат натрия используют в качестве компонента к антифризу, левулинаты кальция и магния являются стимуляторами растений, эфиры левулиновой кислоты являются хорошими пластификаторами, нитрил левулиновой кислоты применяют в синтезе левулиновой кислоты и её солей.
Сама левулиновая кислота является консервантом. Обладает антисептическими свойствами.
В настоящее время (на 2015 год) левулиновая кислота рассматривается как потенциальный заменитель топлива из нефтепродуктов в экономике, в Италии ведутся исследования по её производству в промышленных масштабах из пищевых и сельскохозяйственных отходов.[4]
Примечания
- ↑ Неницеску К.Д. Органическая химия / Под ред. акад. М.И. Кабачника. Перевод с румынского Л. Бырлэдяну. — М.: Издательство иностранной литературы, 1963. — Т. 2. — 1050 с.
- ↑ George W. Huber, Sara Iborra, = Avelino Corma «Synthesis of Transportation Fuels from Biomass: Chemistry, Catalysts, and Engineering» Chemical Reviews 2006, vol. 106, 4044-4098. doi:10.1021/cr068360d
- ↑ Чичибабин А. Е. Основные начала органической химии Том 1 Издание 6. 1954 год
- ↑ Mathieu Flamini’s no fuel. Дата обращения: 27 декабря 2015. Архивировано 16 декабря 2015 года.
Литература
- Гауптман З., Грефе Ю., Ремане Х. Органическая химия / Под ред. проф. В.М.Потапова. Перевод с немецкого канд. хим. наук П.Б.Терентьева и канд. хим. наук С.С. Чуранова. — М.: «Химия», 1979. — 832 с.