Полутяжёлая вода
| Полутяжёлая вода | |
|---|---|
 | |
| Общие | |
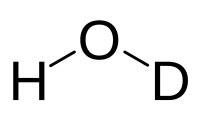
| Хим. формула | HDO |
| Классификация | |
| Рег. номер CAS | 14940-63-7 |
| PubChem | 139859 |
| SMILES | |
| InChI | |
| ChEBI | 33806 |
| ChemSpider | 123344 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Полутяжёлая вода (дейтериевая вода, монодейтериевая вода, гидроксид дейтерия)—вода с заменой одного из протиев на дейтерий (2H; или, что менее правильно D[1])[2]. Формула полутяжёлой воды: DHO или 1H2HO. Полутяжёлая вода существует всегда, когда в смеси присутствует вода с изотопами водорода 1H и 2H. Это происходит потому, что изотопы водорода быстро обмениваются между молекулами воды. Вода с 50 % содержанием 1H и 50 % содержанием 2H, представляет собой около 50 % 1H2HO и по 25 % H2O и 2H 2 O (D2O), находящихся в динамическом равновесии[3]. В обычной воде примерно 1 молекула из 3200 — это полутяжёлая вода HDO (1H2HO) (один атом водорода из 6400 — это 2H). Для сравнения, тяжелая вода D2O (2H2O)[4] встречается в пропорции около 1 молекулы на 41 миллион (то есть 1 на 6400 2). Это делает полутяжёлую воду гораздо более распространённой, чем «обычная» тяжелая вода.
Температура замерзания полутяжелой воды 3,8 °C по сравнению с 3,82 °C у тяжелой воды.
Производство
На Земле полутяжелая вода встречается в естественном виде в обычной воде в пропорции примерно 1 молекула на 3200, поскольку 1 из 6400 атомов водорода в воде — это дейтерий, который по весу составляет 1 часть на 3200. HDO можно получить из обычной воды такими способами, как:
- дистилляция
- электролиз
- различные процессы химического обмена с кинетическим изотопным эффектом .
Частичное обогащение происходит также в естественных водоемах при определённых условиях испарения (более подробную информацию о распределении дейтерия в воде см. в документах Венский стандарт средней океанической водыи Биогеохимия изотопов водорода).
Сравнение физических свойств
| Параметр | D2O | HDO | H2O |
|---|---|---|---|
| Температура плавления, °C | 3,82 | 3,8 | 0,00 |
| Температура кипения, °C | 101,42 | 100,7 | 99,974 |
| Плотность при 20 °C, г/см³ | 1,1056 | 1,054 | 0,9982 |
| Плотность жидкости при температуре плавления, г/см³ | 1,10546 | — | 0,99984 |
| Плотность льда при температуре плавления, г/см³ | 1,0175 | — | 0,91672 |
| Температура максимальной плотности, °C | 11,6 | — | 4,0 |
| Вязкость при 20 °C, сантипуаз | 1,2467 | 1,1248 | 1,0016 |
| Поверхностное натяжение при 25 °C, дин·см | 71,87 | 71,93 | 71,98 |
| Молярное уменьшение объёма при плавлении, см³/моль | 1,567 | 1,634 | |
| Молярная теплота плавления, ккал/моль | 1,515 | 1,436 | |
| Молярная теплота парообразования, ккал/моль | 10,864 | 10,757 | 10,515 |
| pH при 25 °C | 7,41 | 7,266 | 7,00 |
См. также
Примечания
- ↑ Provisional Recommendations. Nomenclature of Inorganic Chemistry. IUPAC. Дата обращения: 30 декабря 2024. Архивировано из оригинала 27 октября 2006 года.
- ↑ Tashakor S (28 сентября 2016). Neutronic Investigation of Semi-Heavy Water Application in Hplwr New Flow Pattern. CNL Nuclear Review (англ.): 1–5. doi:10.12943/CNR.2016.00019.
- ↑ Goncharuk VV, Kavitskaya AA, Romanyukina IY, Loboda OA (June 2013). Revealing water's secrets: deuterium depleted water. Chemistry Central Journal. 7 (1): 103. doi:10.1186/1752-153X-7-103. PMC 3703265. PMID 23773696.
- ↑ Heavy water | chemical compound (англ.). Encyclopedia Britannica. Дата обращения: 24 апреля 2019.
- ↑ Chaplin M. Water properties. — Water Structure and Science.
Дальнейшее чтение
- Schwarzer D, Lindner J, Vöhringer P (October 2005). Energy relaxation versus spectral diffusion of the OH-stretching vibration of HOD in liquid-to-supercritical deuterated water. The Journal of Chemical Physics. 123 (16): 161105. Bibcode:2005JChPh.123p1105S. doi:10.1063/1.2110087. hdl:11858/00-001M-0000-0012-E7B7-2. PMID 16268674.
