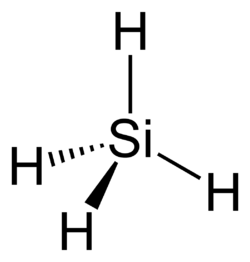
Моносилан
| Моносилан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Моносилан |
| Традиционные названия | Водородистый кремний, гидрид кремния |
| Хим. формула | SiH4 |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 32,12 г/моль |
| Плотность | 1,44 г/л; 1,313 г/л; 0,68-185 г/см³ |
| Энергия ионизации | 11,65 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | -185 °C |
| • кипения | -111,9; -111,2 °C |
| • разложения | 450 °C |
| Критическая точка | |
| • температура | -3 °C |
| • давление | 42,8 атм |
| Критическая плотность | 0,309 см³/моль |
| Мол. теплоёмк. | 42,79 Дж/(моль·К) |
| Энтальпия | |
| • образования | 34,7 кДж/моль |
| • плавления | 0,667 кДж/моль |
| • кипения | 12,43 кДж/моль |
| Давление пара | 1 ± 1 атм[2] |
| Структура | |
| Дипольный момент | 0 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 7803-62-5 |
| PubChem | 23953 |
| Рег. номер EINECS | 232-263-4 |
| SMILES | |
| InChI | |
| RTECS | VV1400000 |
| ChEBI | 29389 |
| Номер ООН | 2203 |
| ChemSpider | 22393 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Моносилан — бинарное неорганическое соединение кремния и водорода с формулой SiH4, бесцветный газ с неприятным запахом, самовоспламеняется на воздухе, реагирует с водой, ядовит.
Получение
- Реакция тетрахлорида кремния и тетрагидридоалюмината лития в эфире:
- Реакция силицида магния с разбавленными кислотами (лучше — фосфорной):
- Реакция тетрахлорида кремния с водородом при 1200—1300 °C:
Физические свойства
Моносилан представляет собой бесцветный газ с неприятным запахом, самовоспламеняющийся на воздухе. Не растворяется в этаноле, бензоле и холодной воде.
Химические свойства
Моносилан весьма реакционноспособный, является сильным восстановителем.
- Энергично разлагается в горячей воде:
- Взаимодействует с галогенами со взрывом при комнатной температуре:
- Разлагается при температуре 400—1000 °C:
- Воспламеняется на воздухе при комнатной температуре:
- Реагирует с концентрированным раствором гидроксида натрия:
- Окисляется перманганатом калия:
Примечания
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ http://www.cdc.gov/niosh/npg/npgd0556.html
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 3. — 392 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — М.: Химия, 1996. — С. 111,117. — 479 с. — 5000 экз. — ISBN 5-7245-0948-2.
- Симанова С. А., Башмаков В. И. 3 // Общая и неорганическая химия. — М.: Академкнига, 2006. — Т. 2. — С. 181. — 544 с. — 2000 экз. — ISBN 5-94628-256-5.
