Протопорфириноген IX оксидаза
| Протопорфириноген IX оксидаза | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | PPOXprotoporphyrinogen oxidase | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | GeneCards: | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Протопорфириноген IX оксидаза | |
|---|---|
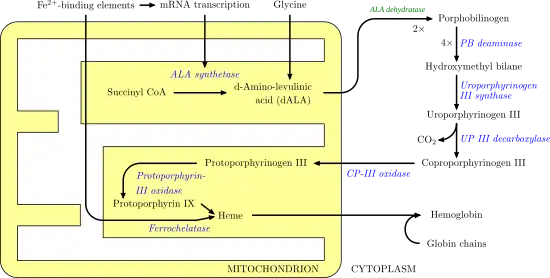 Биосинтез гема— обратите внимание, что некоторые реакции происходят в цитозоле, а некоторые — в митохондрии (жёлтый цвет) | |
| Идентификаторы | |
| Шифр КФ | 1.3.3.4 |
| Номер CAS | 53986-32-6 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 53986-32-6 |
Протопорфириноген IX оксидаза, также протопорфириноген оксидаза (сокр. ППГ-IX-оксидаза) — фермент (1.3.3.4) из семейства оксидазы (класс оксидоредуктазы), катализирует реакцию окисления протопорфориногена IX до протопорфирина IX, путём отщепления 6 атомов водорода по схеме:
- протопорфириноген IX + 3O2 → протопорфирин IX + 3H2O2

Данная реакция является седьмой в биосинтезе гема и протекает в матриксе митохондрий. Фермент является флавопротеином и использует ФАД в качестве простетической группы[1].
У человека фермент кодируется геном PPOX, который локализован на длинном плече (q-плече) 1-хромосомы[2][3][4]. Длина полипептидной цепи белка составляет 477 аминокислот, а молекулярная масса — 50 765 Да[1]. Данный фермент является мишенью некоторых гербицидов.
Функции
PPOX — это ген, который кодирует предпоследний фермент биосинтеза гема, катализирующий 6-электронное окисление протопорфириногена IX с образованием протопорфирина IX. Данный белок представляет собой флавопротеин, связанный с внешней поверхностью внутренней митохондриальной мембраны[4].
Клиническое значение
Вариегатная порфирия является генетическим заболеванием, которое наследуется по аутосомно-доминантному типу и вызывается мутациями в гене PPOX. В гене PPOX выявлено более 100 мутаций, которые могут вызывать вариегатную порфирию. Одна мутация — замена аминокислоты триптофана на аргинин в позиции 59 (также пишется как Arg59Trp или R59W) — встречается примерно в 95 % южноафриканских семей с вариегатной порфирией. Мутации, происходящие в гене PPOX снижают активность фермента, экспрессируемым этим геном, что позволяет накапливаться в организме побочным продуктам биосинтеза гема, например, протопорфириногена IX, который в коже под действием солнечных лучей превращается в токсичный протопорфирин, способный вызвать фотодерматит, сопровождаемый эрозивно-язвенными повреждениями и буллёзной сыпью (медленно заживляемые). Такое накопление в сочетании с негенетическими факторами (такими, как приём некоторых лекарств, алкоголя и диета) вызывает данный тип порфирии.
Ингибиторы
Ингибирование протопорфириноген оксидазы является механизмом действия ряда коммерческих гербицидов, в том числе нитрофениловых эфиров ацифлуорфена и фомесафена, а также пиримидинидионов бутафенацила и сафлуфенацила. Визуальными результатами обработки растений являются хлороз и усыхание. Повреждения вызываются накоплением в клетках растений протопорфирина IX, ингибирующего ППГ-IX-оксидазу на пути биосинтеза тетрапирролов. Это мощный фотосенсибилизатор, активирующий кислород, что приводит к перекисному окислению липидов. Для того чтобы этот процесс привёл к гибели растения, необходимы как свет, так и кислород[5][6][7].
Примечания
- 1 2 UniProt, P50336 (англ.).
- ↑ Taketani S, Inazawa J, Abe T, Furukawa T, Kohno H, Tokunaga R, et al. (October 1995). The human protoporphyrinogen oxidase gene (PPOX): organization and location to chromosome 1. Genomics. 29 (3): 698–703. doi:10.1006/geno.1995.9949. PMID 8575762.
- ↑ Frank J, McGrath JA, Poh-Fitzpatrick MB, Hawk JL, Christiano AM (July 1999). Mutations in the translation initiation codon of the protoporphyrinogen oxidase gene underlie variegate porphyria. Clinical and Experimental Dermatology. 24 (4): 296–301. doi:10.1046/j.1365-2230.1999.00484.x. PMID 10457135. S2CID 40509390.
- 1 2 Entrez Gene: PPOX protoporphyrinogen oxidase.
- ↑ Structure-Activity Relationships of Diphenyl Ethers and Other Oxygen-Bridged Protoporphyrinogen Oxidase Inhibitors // Peroxidizing Herbicides. — 1999. — P. 141–161. — ISBN 978-3-642-63674-5. — doi:10.1007/978-3-642-58633-0_5.
- ↑ Herbicidal Efficacy of Protoporphyrinogen Oxidase Inhibitors // Peroxidizing Herbicides. — 1999. — P. 293–302. — ISBN 978-3-642-63674-5. — doi:10.1007/978-3-642-58633-0_11.
- ↑ Protoporphyrinogen Oxidase-Inhibiting Herbicides // Hayes' Handbook of Pesticide Toxicology. — 2010. — P. 1733–1751. — ISBN 9780123743671. — doi:10.1016/B978-0-12-374367-1.00081-1.
