Сульфат цезия
| Сульфат цезия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Сульфат цезия |
| Традиционные названия | Сернокислый цезий |
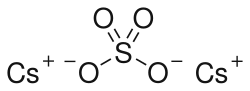
| Хим. формула | Cs2SO4 |
| Физические свойства | |
| Состояние | белое кристаллическое вещество |
| Молярная масса | 361,87 г/моль |
| Плотность | 4,243 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1019 °C |
| Мол. теплоёмк. | 134,9 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1442,9 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 178,3720; 210,380 г/100 мл |
| • в этиленгликоле | 5,28 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,56 |
| Классификация | |
| Рег. номер CAS | 10294-54-9 |
| PubChem | 25137 |
| Рег. номер EINECS | 233-662-6 |
| SMILES | |
| InChI | |
| ChemSpider | 23482 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат цезия — неорганическое соединение, соль цезия и серной кислоты с химической формулой Cs2SO4.
Получение
- Сульфат цезия можно получить действием разбавленной серной кислоты на металлический цезий, его оксид, гидроксид или карбонат:
- Также сульфат цезия получают обменными реакциями:
- Окисление сульфида цезия:
Физические свойства
Сульфат цезия образует бесцветные кристаллы, ромбическая сингония, пространственная группа P nam, a = 0,822 нм, b = 1,092 нм, c = 0,624 нм, Z = 4. При температуре выше 647 °C переходит в гексагональную модификацию. При температуре 1400 °C начинает заметно возгоняться без изменения состава.
Хорошо растворим в воде, не подвергается гидролизу, кристаллогидратов не образует. Не растворяется в этаноле и ацетоне.
Из соляной кислоты выпадают сольваты 5Cs2SO4•4HCl.
Химические свойства
- Как соль двухосновной кислоты образует кислые соли:
- Как все сульфаты взаимодействует с растворимыми соединениями бария:
- Восстанавливается до сульфида:
- С некоторыми сульфатами образует квасцы:
Применение
- Производство катализаторов для неорганического синтеза.
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, цезия и цезия. — М.: «Химия», 1970. — 408 с.