Тиосульфат магния
| Тиосульфат магния | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Тиосульфат магния |
| Традиционные названия | Тиосернокислый магний; серноватистокислый магний; гипосульфит магния |
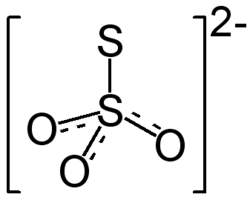
| Хим. формула | MgS2O3 |
| Рац. формула | MgSO3S |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 136,43 г/моль |
| Плотность | 1,236; гидрат - 1,818 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1710 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 49,820; 51,925 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10124-53-5, 13446-30-5 |
| PubChem | 160917 |
| Рег. номер EINECS | 233-340-5 |
| SMILES | |
| InChI | |
| ChemSpider | 141374 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тиосульфат магния — неорганическое соединение, соль магния и тиосерной кислоты с формулой MgS2O3, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- Обменная реакция сульфата магния и тиосульфата бария:
- Кипячение раствора сульфита магния с серой:
Физические свойства
Тиосульфат магния образует бесцветные кристаллы.
Растворяется в воде, не растворяется в этаноле.
Образует кристаллогидрат состава MgS2O3•6H2O, который теряет воду при 170-420°С — бесцветные кристаллы ромбической сингонии, пространственная группа P nma, параметры ячейки a = 0,9324 нм, b = 1,4461 нм, c = 0,6862 нм, Z = 4 (при 120 К) [1].
Химические свойства
- Окисляется при нагревании на воздухе:
Применение
- Лекарственное средство при некоторых сердечно-сосудистых заболеваниях, вегетативных расстройствах.
Примечания
- ↑ Y. Elerman, J. W. Bats and H. Fuess,. Deformation density in complex anions. IV. Magnesium thiosulfate hexahydrate, MgS2O3.6H2O // Acta Crystallographica Section C. — 1983. — Т. C39, № 5. — С. 515-518. — doi:10.1107/S0108270183005338.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
- Richard C. Ropp,. Encyclopedia of the Alkaline Earth Compounds. — Elsevier, 2013. — ISBN 978-0-444-59550-8.