Фосфорноватая кислота
| Фосфорноватая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Фосфорноватая кислота |
| Традиционные названия | Гипофосфорная кислота |
| Хим. формула | H4P2O6 |
| Физические свойства | |
| Молярная масса | 161,97 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 55; 70; 73 °C |
| Энтальпия | |
| • образования | -1638,6 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7803-60-3 |
| PubChem | 24536 |
| SMILES | |
| InChI | |
| ChEBI | 29263 |
| ChemSpider | 22943 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фосфорноватая кислота — неорганическое соединение, четырёхосновная кислота с формулой H4P2O6, бесцветные кристаллы, растворяется в холодной воде с медленным разложением, образует кристаллогидраты.
Получение
- Разрушая суспензию гипофосфата свинца сероводородом:
- Окисление воздухом фосфористой кислоты:
Физические свойства
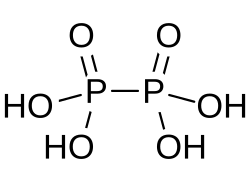
Фосфорноватая кислота образует бесцветные кристаллы, молекула имеет строение (HO)2(O)P—P(O)(OH)2.
Растворяется в холодной воде с медленным разложением.
Является четырёхосновной кислотой с константами диссоциации pK1 = 2,2; pK2 = 2,3; pK3 = 7,3; pK4 = 10,0.
Образует кристаллогидраты вида H4P2O6• H2O и H4P2O6• 2H2O.
Химические свойства
- При хранении медленно изомеризуется в фосфористофосфорную кислоту:
- При нагревании переходит в фосфористую и метафосфорную кислоту:
- Из кристаллогидрата можно получить безводную кислоту медленным высушиванием в вакууме над P2O5:
- При нагревании кристаллогидрат разлагается. Подобным образом разлагается в горячей воде:
- С разбавленными щелочами образует кислые соли, с концентрированными — нормальные соли — гипофосфаты:
- Окисляется перманганатом калия:
См. также
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.